-
Numero contenuti
25455 -
Iscritto
-
Ultima visita
Tipo di contenuto
Profili
Forum
Orchidee
Diventa Socio
Calendario
Messaggi pubblicati da Tomaso Lezzi
-
-
Cantharellus pallens Pilát. Regione Umbria. Maggio 2025. Foto di Tomaso Lezzi.

-
Pluteus romellii (Britzelm.) Sacc. Regione Umbria. Aprile 2025. Foto di Tomaso Lezzi.


-
Helvella calycina Skrede, T. Carlsen & T. Schumach 2017. Regione Umbria. Aprile 2025. Foto di Tomaso Lezzi.

-
Stai dicendo una cosa esattissima, bisogna crearsi un database mentale degli odori.

Una volta capito quale è una specie, associarla al suo odore, dopodiché associarlo alla definizione del suo odore, cosa non sempre facile.
Ad esempio alcune Russula hanno un odore che viene definito di "gamberetti cotti". Ti assicuro che finché non ti confronti nella realtà con questo odore, difficilmente potrai dire gamberetti cotti, ma una volta associato quell'odore a quella definizione, sarà molto più facile associarlo poi al fungo o al gruppo di funghi che hanno quell'odore!Tom

-
Ciao Gabriele,
Ti ho spostato la discussione nell'area Funghi da determinare.
Quando vuoi determinare dei funghi, apri una discussione diversa per ogni specie.
Ti ho separato io le foto.In ognuna delle discussioni pubblica 1 sola foto nel primo post di dimensione 250 KB ca, 800×600 px. Dopodiché pubblica una seconda foto nel secondo post della stessa discussione, come se rispondessi a te stesso, e così via.
In questo modo le foto saranno più leggibili e daranno anche più informazioni per la determinazione dei tuoi campioni.Ciò premesso il tuo ritrovamento è un Pluteus sp., forse un Pluteus cervinus.
È importante controllare l'odore dei funghi, questo probabilmente avrebbe avuto un odore rafanoide, se è la specie ipotizzata.Ciao e buona permanenza, Tom

-
Ciao Gabriele,
Ti ho spostato la discussione nell'area Funghi da determinare.
Quando vuoi determinare dei funghi, apri una discussione diversa per ogni specie.
Ti ho separato io le foto.In ognuna delle discussioni pubblica 1 sola foto nel primo post di dimensione 250 KB ca, 800×600 px. Dopodiché pubblica una seconda foto nel secondo post della stessa discussione, come se rispondessi a te stesso, e così via.
In questo modo le foto saranno più leggibili e daranno anche più informazioni per la determinazione dei tuoi campioni.Ciò premesso il tuo ritrovamento è una Inocybe è importante controllare l'odore dei funghi, questo probabilmente avrebbe avuto un odore spermatico, se è la specie ipotizzata.
Ciao e buona permanenza, Tom

-
Ringraziamo il socio Francesco Bergo per la sua adesione alla nostra Associazione Micologica e Botanica AMINT, la sua nuova iscrizione rende più forte l'autofinanziamento e il sostegno alle nostre iniziative informative, culturali e didattiche.
Il Presidente AMINT
Tale comunicazione telematica, è valida ad ogni effetto, come ricevuta dell'avvenuto pagamento per l'iscrizione all'Associazione AMINT per l'anno 2025.
-
-
Ringraziamo il socio Raffaele D'Aquino per la sua adesione alla nostra Associazione Micologica e Botanica AMINT, la sua nuova iscrizione rende più forte l'autofinanziamento e il sostegno alle nostre iniziative informative, culturali e didattiche.
Il Presidente AMINT
Tale comunicazione telematica, è valida ad ogni effetto, come ricevuta dell'avvenuto pagamento per l'iscrizione all'Associazione AMINT per l'anno 2025.
-
Ringraziamo il socio Stefano Bartocci per la sua adesione alla nostra Associazione Micologica e Botanica AMINT, la sua nuova iscrizione rende più forte l'autofinanziamento e il sostegno alle nostre iniziative informative, culturali e didattiche.
Il Presidente AMINT
Tale comunicazione telematica, è valida ad ogni effetto, come ricevuta dell'avvenuto pagamento per l'iscrizione all'Associazione AMINT per l'anno 2025.
-
-
Ophrys sp.
Tom


-
Dactylorhiza romana
Tom



-
-
Ringraziamo il socio Emidio Vallorani per la sua adesione alla nostra Associazione Micologica e Botanica AMINT, la sua nuova iscrizione rende più forte l'autofinanziamento e il sostegno alle nostre iniziative informative, culturali e didattiche.
Il Presidente AMINT
Tale comunicazione telematica, è valida ad ogni effetto, come ricevuta dell'avvenuto pagamento per l'iscrizione all'Associazione AMINT per l'anno 2025.
-
Lepista nuda (Bull.: Fr.) Cooke. Regione Lazio. Marzo 2025. Foto di Tomaso Lezzi.
Ritrovamento sotto Cupressus semprevirens in un parco pubblico.


Particolare delle lamelle.

Spore (6,9) 7,1-8,5 (10,8) × (4,4) 4,6-5,6 (6,3) µm; Q = (1,3) 1,5-1,66 (1,7); N = 31; Media = 7,8 × 5,1 µm; Qm = 1,5; ellissoidali, verrucose. Osservazione in rosso Congo, a 1000×.
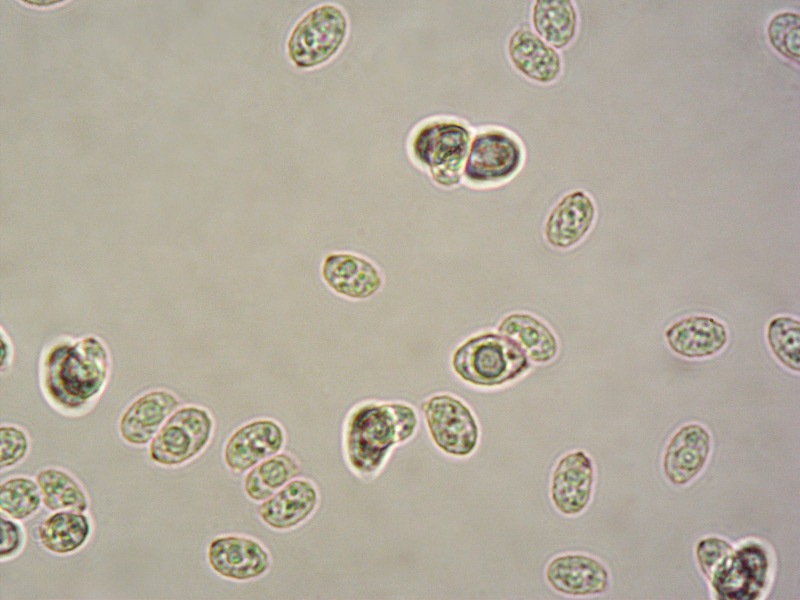
-
Geopora sumneriana (Cooke ex W. Phillips) M. Torre. Regione Umbria. Marzo 2025. Foto di Tomaso Lezzi.
Ritrovamento sotto Cedrus atlantica glauca.




-
Clavulina rugosa (Bull. : Fr.) J. Schröt. Regione Umbria. Gennaio 2025. Foto di Tomaso Lezzi e Luigi Minciarelli.
Specie con le superfici tipicamente rugose.
Spore (7,5) 8,1-10,4 (11,2) × (6,4) 6,7-8,4 (8,8) µm; Q = (1,0) 1,1-1,3 (1,4); N = 33; Media = 9,1 × 7,7 µm; Qm = 1,2; cortamente ellissoidali, subglobose, con grossa guttula centrale.
Le misure sporali rientrano nel range di Clavulina rugosa, anche se sarebbero di poco più vicine a quelle di Clavulina cinerea, che però è morfologicamente differente.
Le tre specie Clavulina rugosa, Clavulina cinerea e Clavulina cristata hanno la caratteristica di essere tutte prevalentemente bisporiche, con abbondanti basidi monosporici.
Clavulina cristata ha superfici lisce, creste con terminali appuntiti e spore più piccole.
Clavulina cinerea mostra sfumature grigio-violette e terminali ottusi (ma a volte anche le altre due specie mostrano questi colori), superfici lisce e misure sporali simili a quelle di Clavulina rugosa.Foto macro Luigi Minciarelli

Foto micro Tomaso Lezzi.
Basidi bisporici. Osservazione in rosso Congo, a 400×.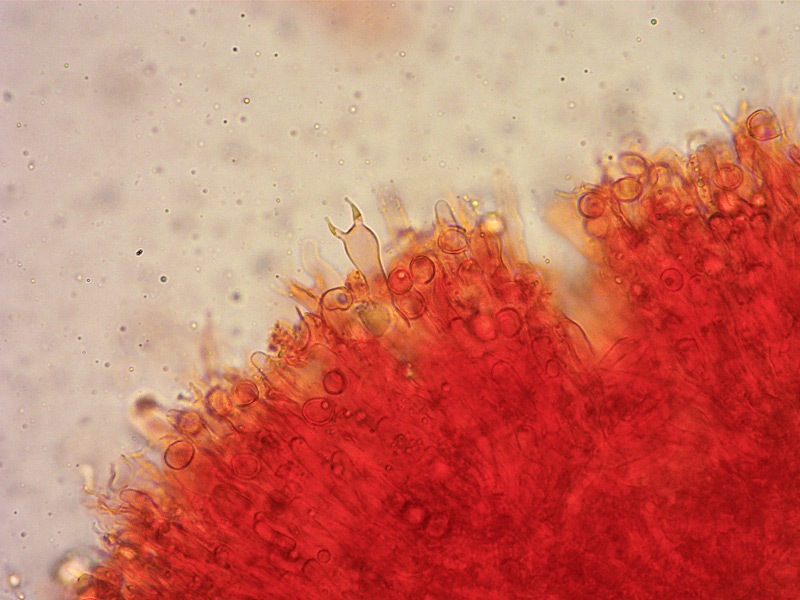
Spore cortamente ellissoidali, subglobose, con grossa guttula centrale. Osservazione in rosso Congo, a 1000×.
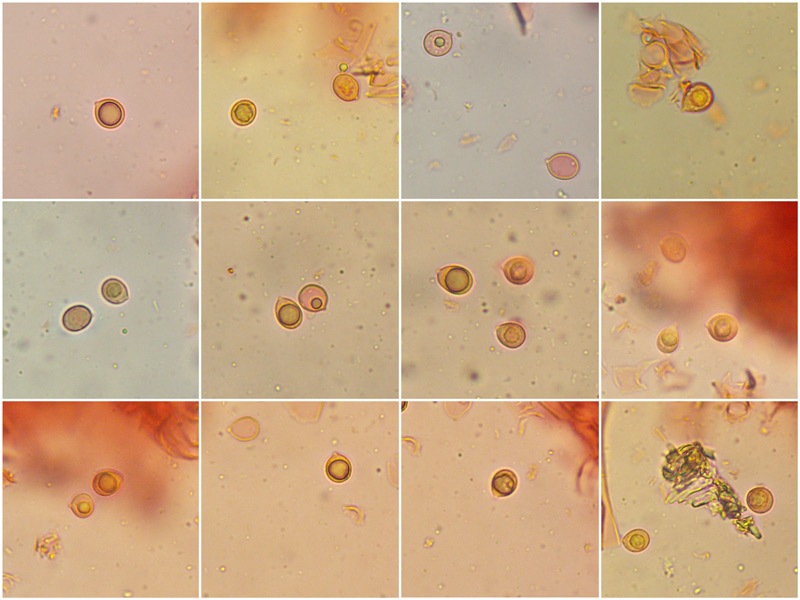
-
Lyophyllum deliberatum (Britzelm.) Kreisel 1984. Regione Umbria. Gennaio 2025. Foto di Tomaso Lezzi e Luigi Minciarelli.
= Lyophyllum infumatum (Bres.) Kühner 1938Nonostante entrambi IF e MB mantengano le due specie Lyophyllum deliberatum e Lyophyllum infumatum (non Lyophyllum fumosum che è altra cosa!) separate, sia Funga Nordica (dando la priorità al 1°), che la monografia di Contu e Consiglio su RdM 2002, 2: 99-181 (dando la priorità al 2°) considerano le due specie come sinonimi, e personalmente mi allineo con questo punto di vista.
Le caratteristiche della specie sono lamelle che al tocco virano prima al blu acciaio e poi al nero (importante la variazione di colore del viraggio per la determinazione) e le spore con profilo a losanga. Ritrovamento in bosco misto: Quercus spp., Pinus nigra, Pinus pinaster, Cedrus atlantica e altre specie arboree.Foto macro Luigi Minciarelli

Particolare del viraggio delle lamelle.

Foto micro Tomaso Lezzi.
Basidi dal profilo allungato. Osservazione in rosso Congo, a 400×.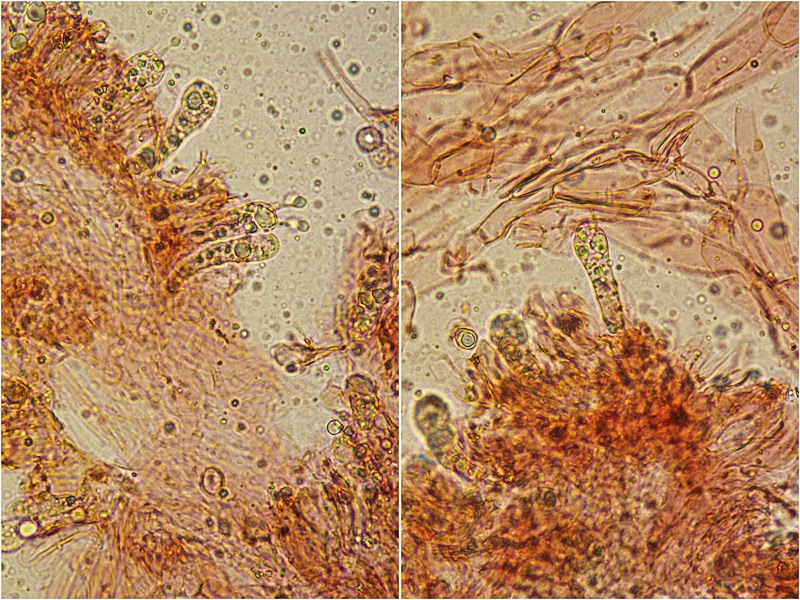
Spore col profilo a losanga. Osservazione in rosso Congo, a 1000×.
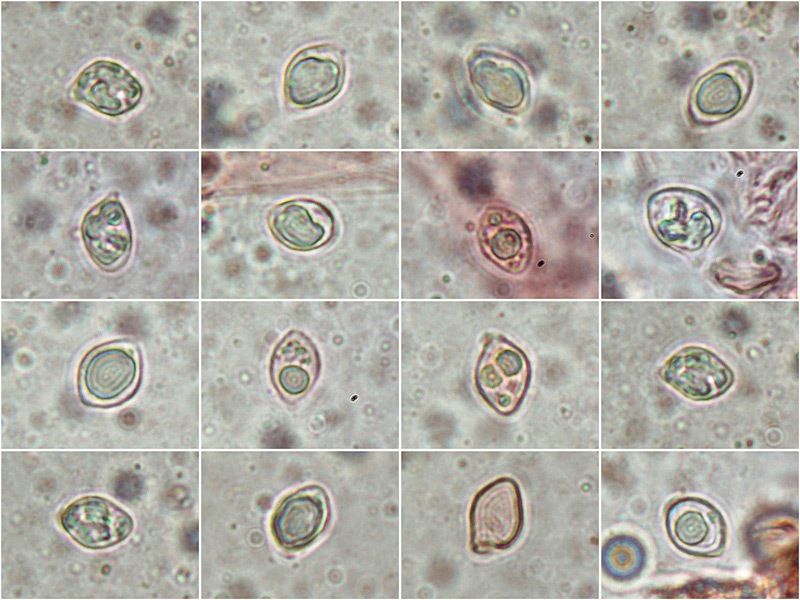
-
-
Ho il piacere di presentare un articolo del Micologo e amico Giovanni Galeotti, che insieme a A. Rubini, R. Para, C. Riccioni e B. Belfiori ha pubblicato due nuove specie di Pseudosperma: Pseudosperma cupreum e Pseudosperma franchettii.
Segue l'abstract dell'articolo.
Description of two new species of Pseudosperma in central Italy
G.B. Galeotti, A. Rubini, R. Para, C. Riccioni, B. BelfioriAbstract
Two new species belonging to the genus Pseudosperma (Inocybaceae) are reported. The basidiocarps were collected from two distinct environments in the Umbria region of central Italy. Pseudosperma cupreum sp. nov. was found in a riparian habitat dominated by Populus sp., Salix sp., and Alnus sp. trees, whereas Pseudosperma franchettii sp. nov. was found in a park with both coniferous and broad-leaved trees. Detailed macro- and micro-morphological descriptions, along with comparisons to similar species, are reported. Phylogenetic analyses based on the sequences of internal transcribed spacer region of rDNA (ITS), parts of the large subunit of rDNA (LSU) and of the second largest subunit of RNA polymerase II (rpb2), confirmed that both species form distinct, well-supported clades, clearly separating them from previously sequenced Pseudosperma specimens.L'articolo, in lingua inglese, è disponibile sul sito di Phytotaxa all'indirizzo: https://doi.org/10.11646/phytotaxa.693.2.1
I miei personali complimenti a tutti gli autori!
Tom
-
Rhizocybe vermicularis (Fr.) Vizzini, G. Moreno, P. Alvarado & Consiglio. Regione Umbria. Marzo 2025. Foto di Tomaso Lezzi.
= Clitocybe vermicularis (Fr.) Quél. 1872Specie caratterizzata da crescita primaverile, con una netta demarcazione tra lamelle e gambo e abbondanti rizoidi bianchi alla base del gambo.
La simile Rhizocybe pruinosa (Lasch: Fr.) Vizzini, G. Moreno & P. Alvarado, 2015 = Clitocybe pruinosa (Lasch) P. Kumm. 1871 = Clitocybe radicellata Godey 1884 = Clitocybe rhizophora s. Joss. & Pouchet 1931, sempre primaverile e con presenza di rizoidi, ha colori del cappello più grigiastri.

-
-



2025.05 - Umbria - Tutor Luigi
in Funghi Trovati Anno 2025
Inviato
Lyophyllum deliberatum (Britzelm.) Kreisel, 1984. Regione Umbria. Maggio 2025. Foto di Tomaso Lezzi e Luigi Minciarelli.
= Lyophyllum infumatum (Bres.) Kühner, Bull. 1938
Lamelle che al tocco virano al blu acciaio, poi al nero.
Spore (9,1) 9,12-10,9 (11,0) × (4,8) 5,1-6,1 (6,3) µm; Q = 1,5-1,99 (2,0); N = 12; Media = 10,0 × 5,5 µm; Qm = 1,8; romboidali.