-
Numero contenuti
14407 -
Iscritto
-
Ultima visita
Tipo di contenuto
Profili
Forum
Orchidee
Diventa Socio
Calendario
Messaggi pubblicati da Archivio Micologico
-
-
Pholiotina teneroides (J.E. Lange) Singer 1936
Divisione Basidiomycota
Classe Agaricomycetes
Ordine Agaricales
Famiglia BolbitiaceaeSinonimi
Conocybe teneroides (J.E. Lange) Kits van Wav. 1970
Conocybe percincta PD Orton. 1960Etimologia
L'epiteto Pholiotina è composto dal nome di genere Pholiota e dal suffisso -ina = piccolo, per il suo aspetto simile a una piccola Pholiota.
L'epiteto teneroides è composto dalla parola tenera da tenuis = tenero, delicato, molle, morbido e dal suffisso-oides dal greco "οειδής" [òide] = simile, affine a.Cappello
5-15 mm, presenta una cuticola leggermente rugosa, di colore bruno aranciato, inizialmente emisferico, poi convesso-campanulato, mai completamente espanso, si decolora per assumere tonalità ocracee a partire dall'esterno, il margine è irregolare, leggermente striato.Lamelle
Imenoforo a lamelle ventricose, adnate e leggermente decorrenti per un dentino all'inserzione con lo stipite, di colore inizialmente biancastro, poi a maturità bruno ocraceo, con tagliente finemente eroso, discolore rispetto alle facce delle lamelle, perchè sterile per la presenza di cheilocistidi.Anello
Membranoso, persistente, spesso, ripiegato su se stesso, disposto sulla parte mediana dello stipite.Gambo
10-40 x 2-3 mm cilindrico a volte sinuoso, giallognolo e traslucido nella parte alta, tende a scurire e assume tonalità bruno rossastre gradualmente verso la base, completamente rivestito da pruina biancastra, leggermente svasato nella parte a contatto con il suolo.Carne
Nel cappello di consistenza esigua e fragile, leggermente fibrosa sul gambo.Habitat
Fungo saprotrofo, fruttifica nel periodo autunno-invernale, su detriti organici tra fogliame e muschio.
Questa specie è poco comune ed è stata segnalata poche volte sul territorio italiano nel 2005 in Friuli-Venezia Giulia e nel Lazio nel 2007.Microscopia
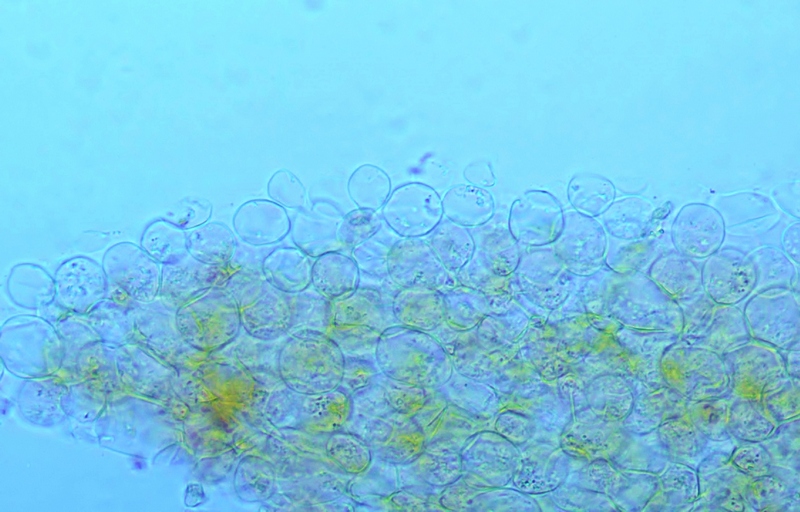
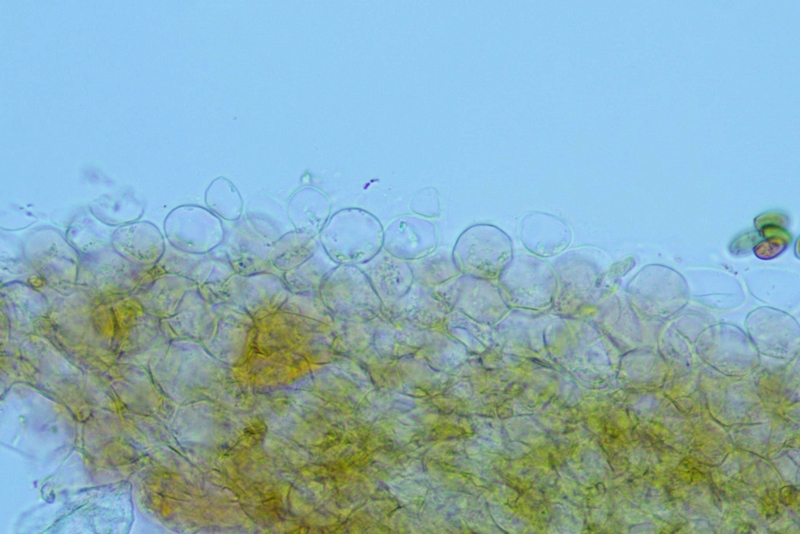
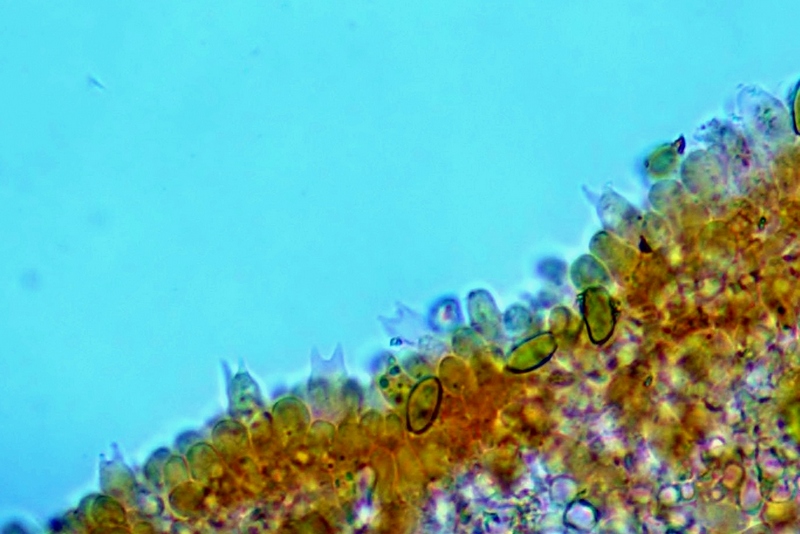
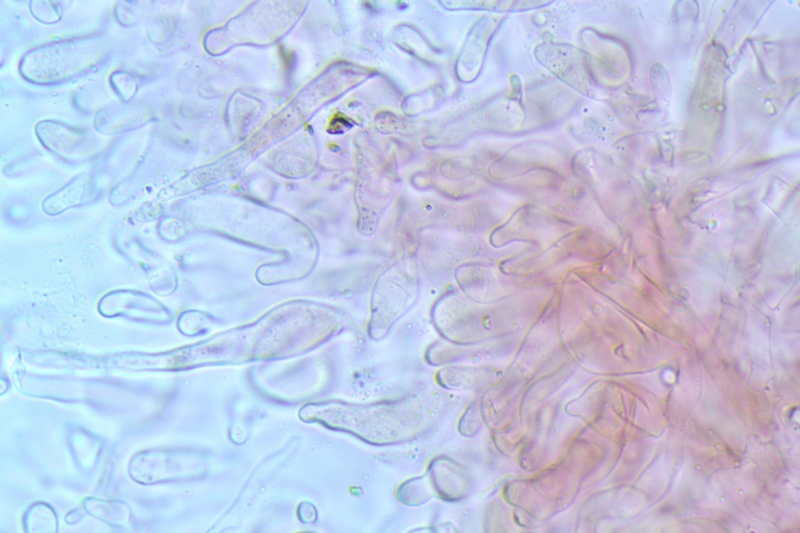
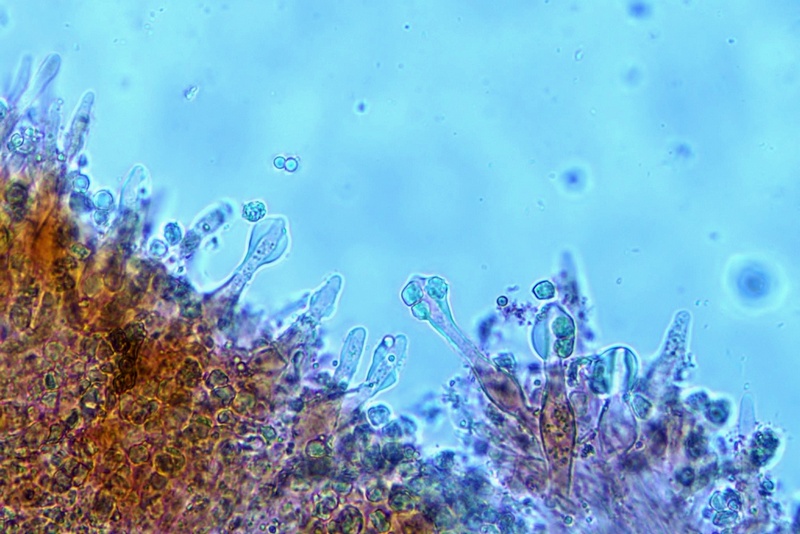
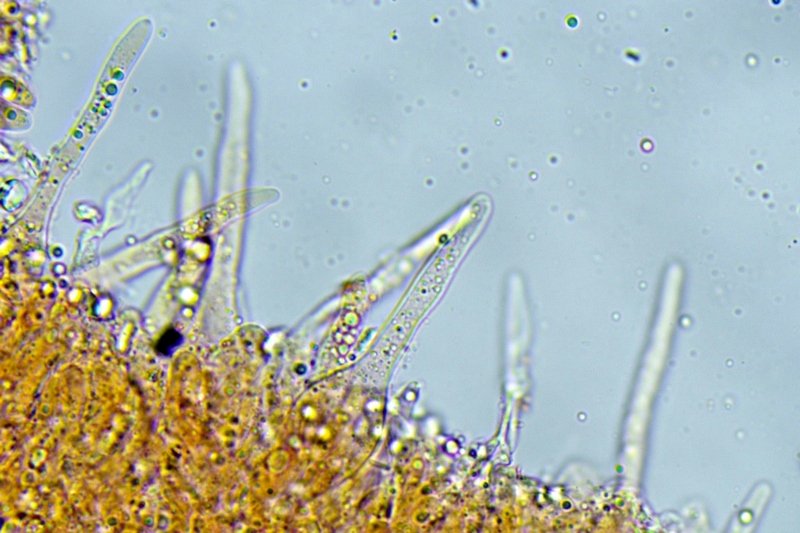
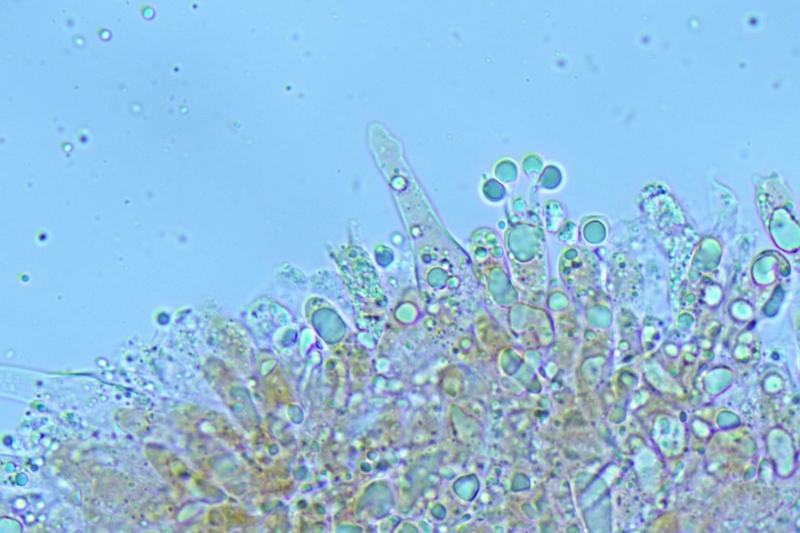
Pileipellis di tipo imeniderma, formato da cellule subglobose e piriformi.
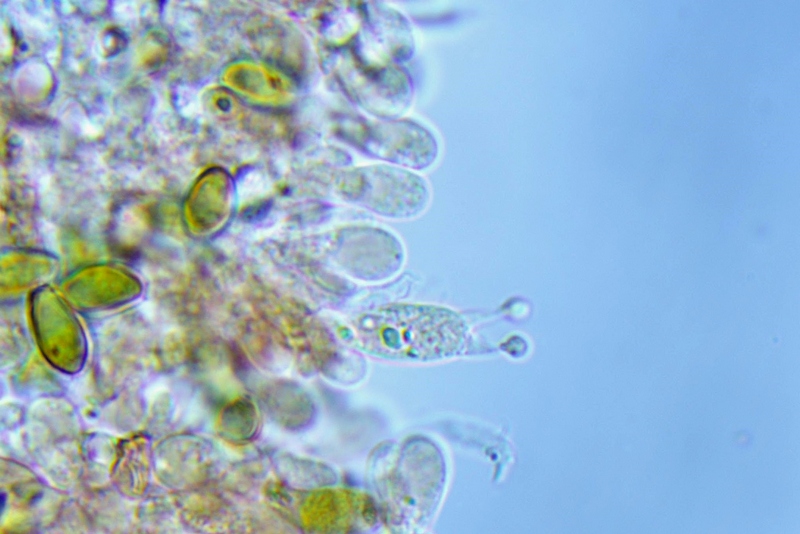
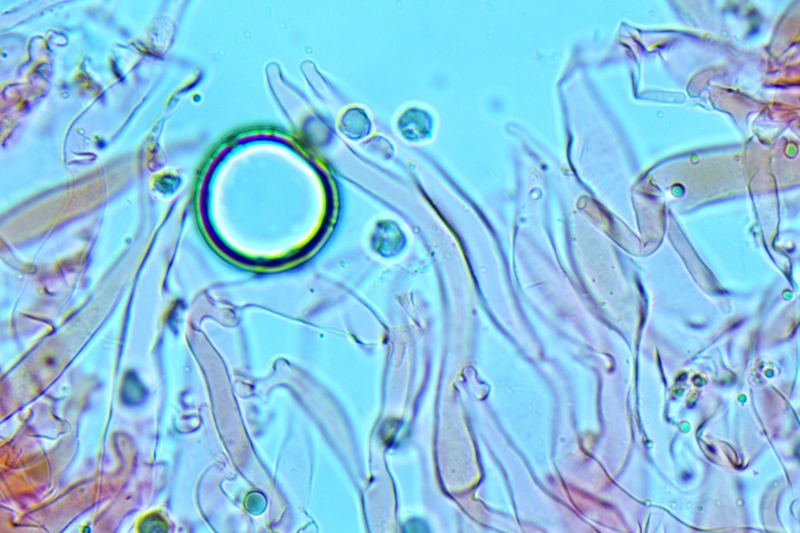
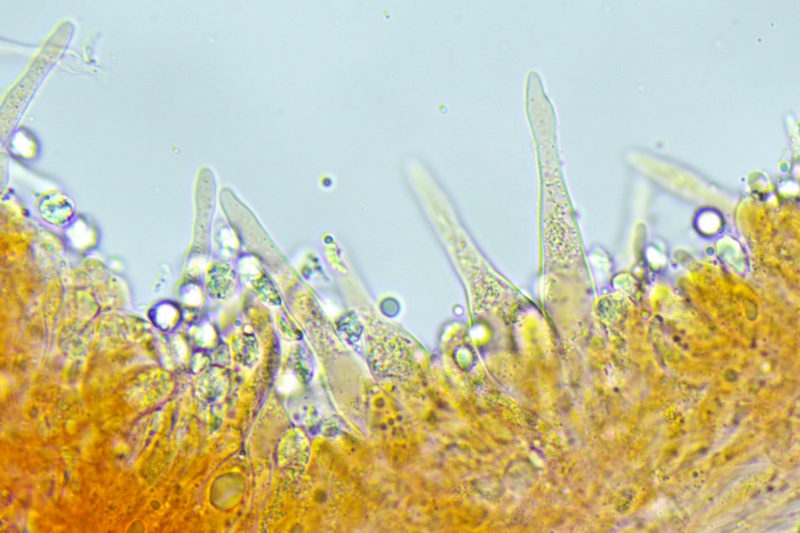
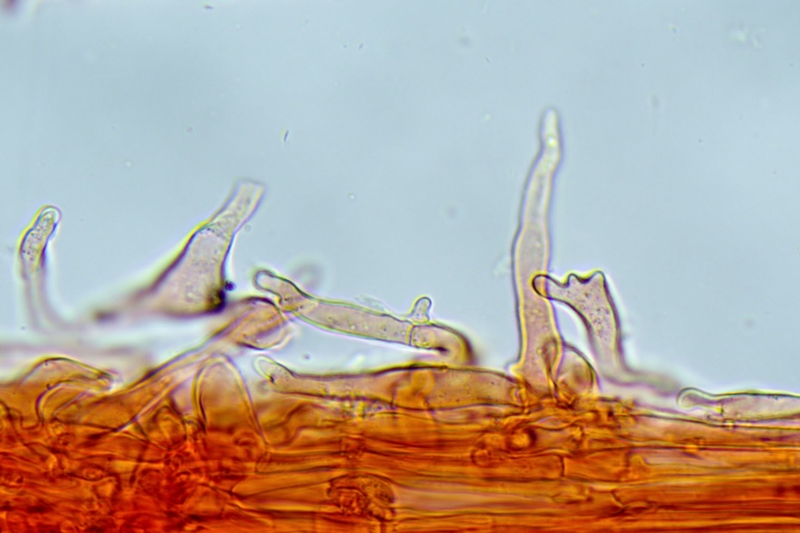
Cheilocistidi principalmente utriformi, alcuni lageniformi e clavati.
Pleurocistidi non osservati.
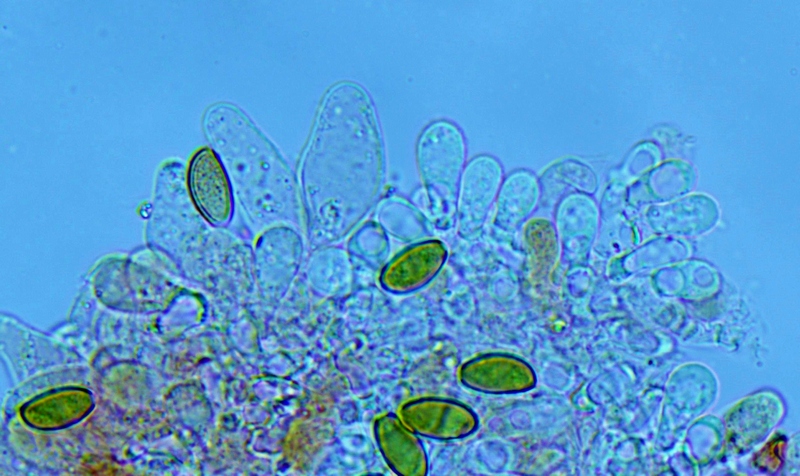
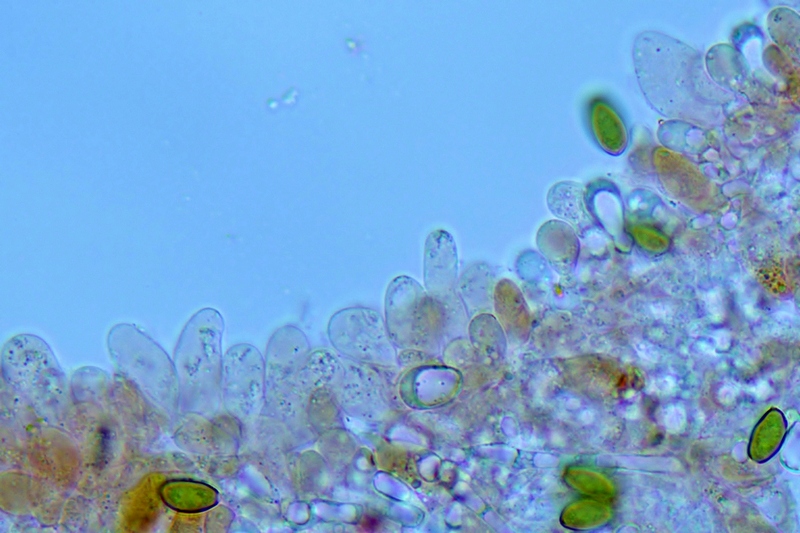
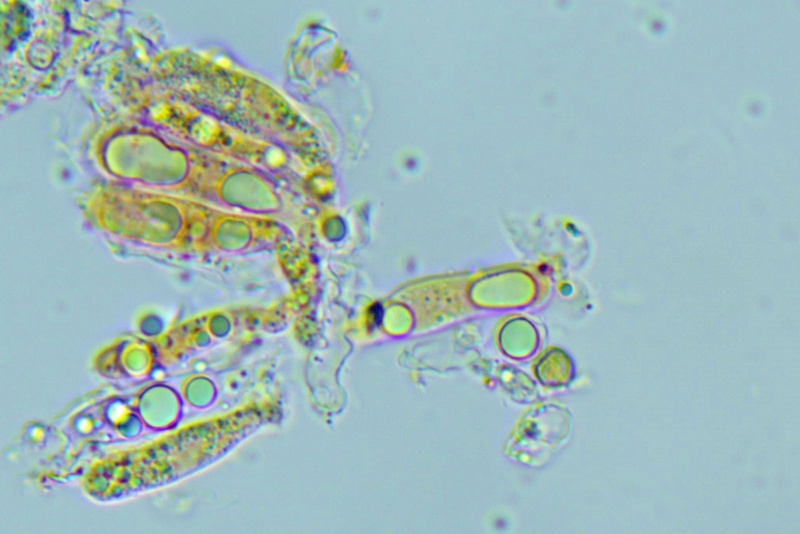
Basidi prevalentemente bisporici, con alcuni monosporici che portano spore molto grandi, fino 15,3 µm.
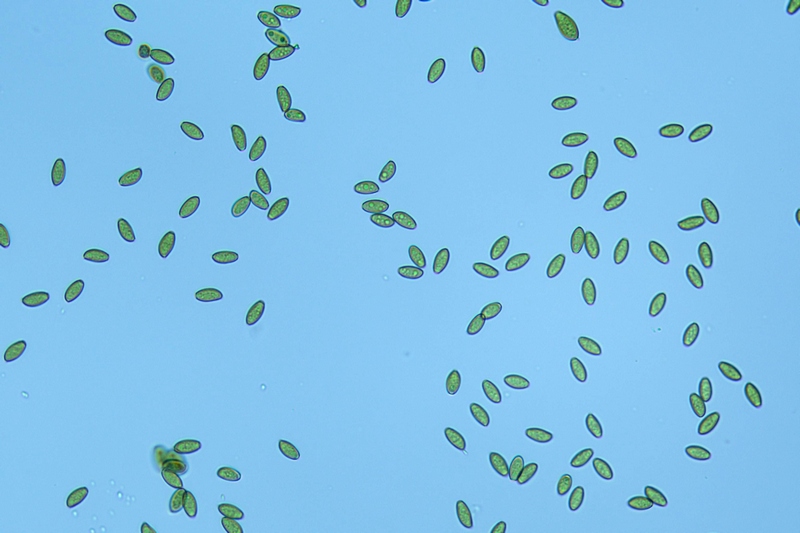
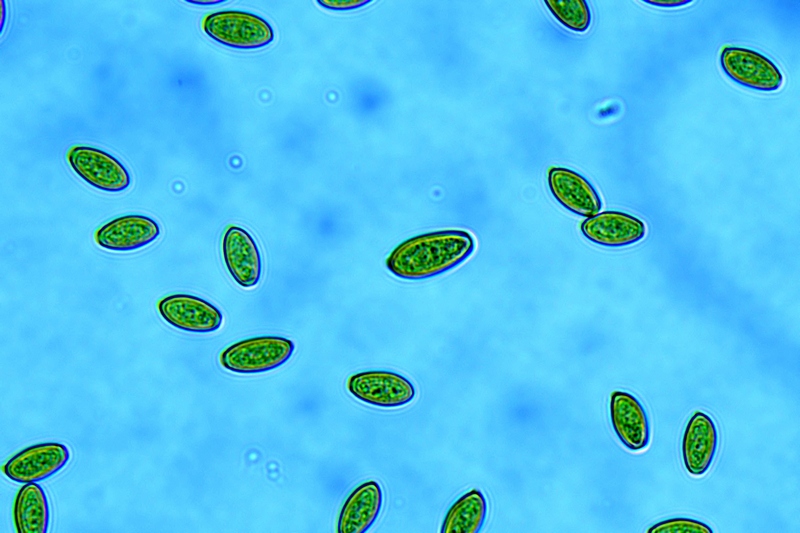
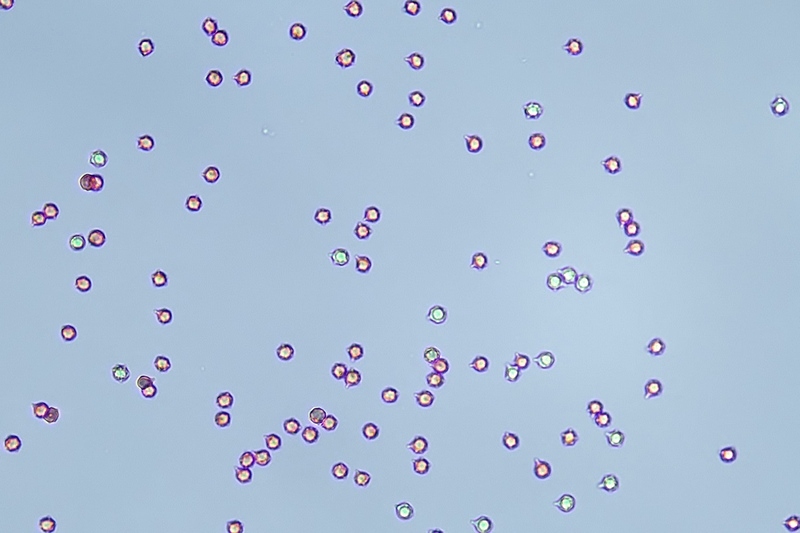
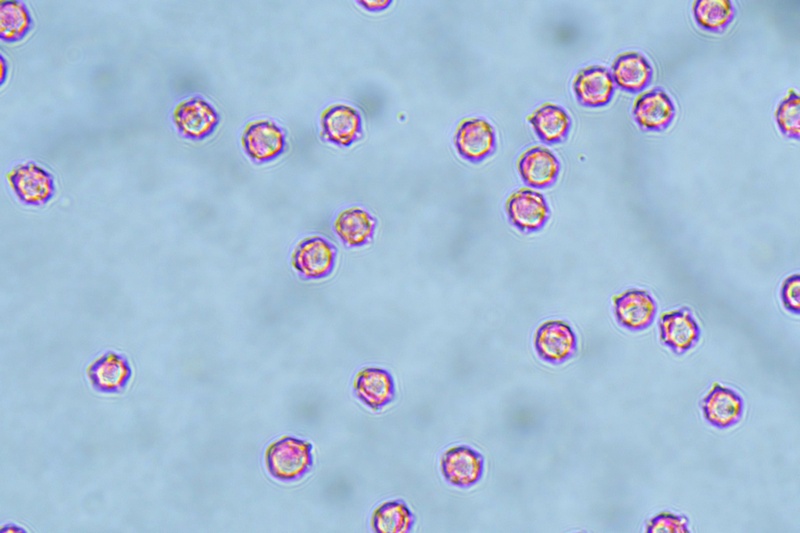
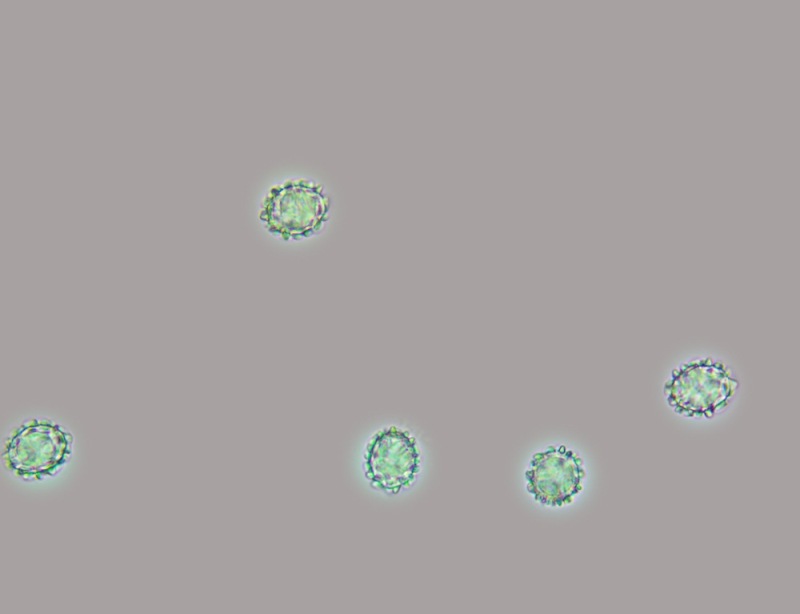
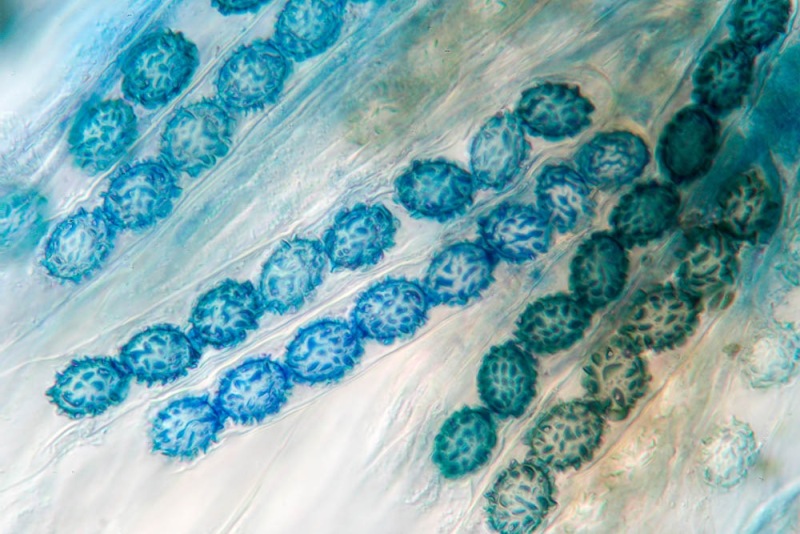
Spore (10,6) 10,8-12,1 (15,3) × (5,1) 5,4-6,3 (7,2) µm; Q = (1,6) 1,8-2,1 (2,2); N = 62; Media = 11,5 × 5,9 µm; Qm = 1,9; lungamente ellissoidali in vista frontale, leggermente amigdaliformi in vista laterale, con poro germinativo, largo 1,6-1,9 µm, apicolo piccolo ma ben evidente in vista laterale.
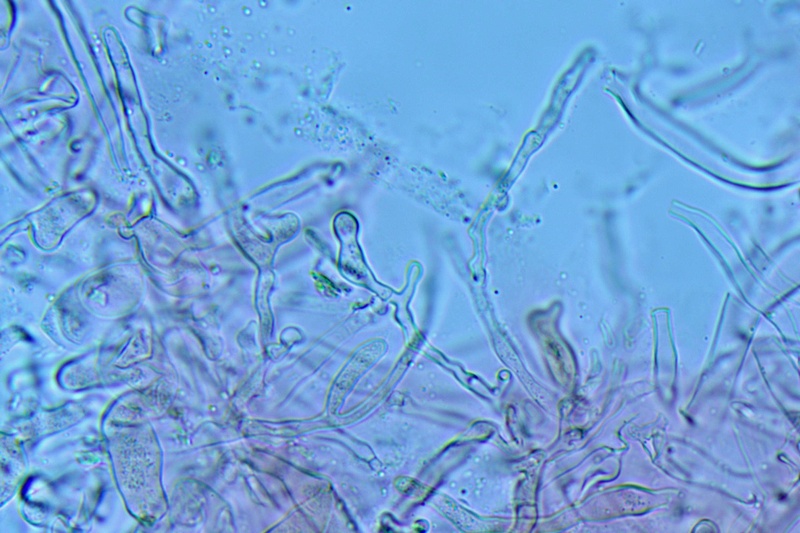
Stipitipellis costituita da una cutis di cellule parallele, cilindriche, settate.
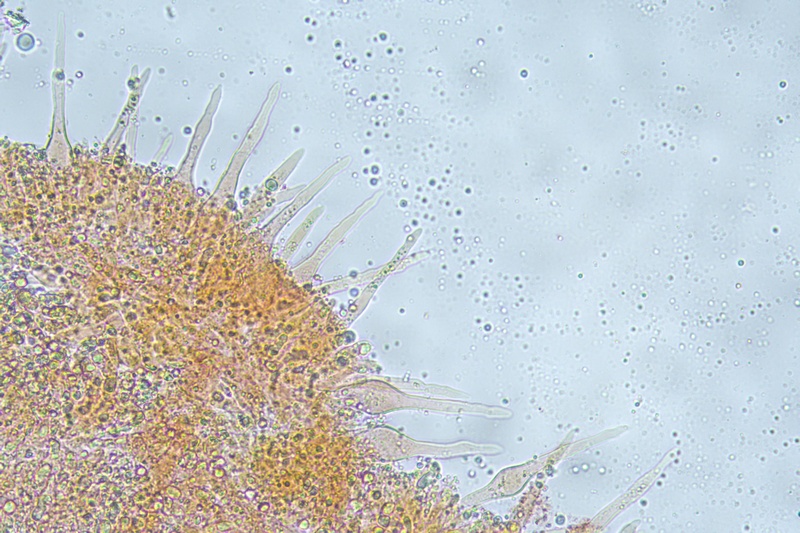
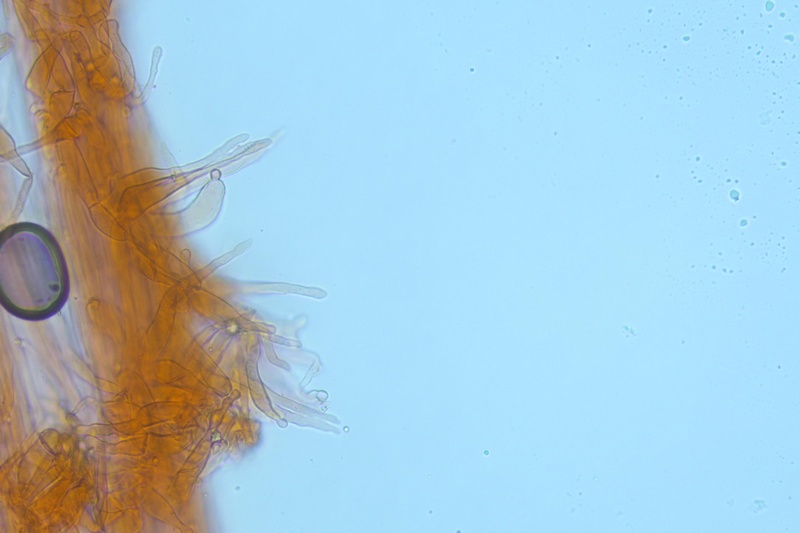
Caulocistidi rari, disposti a mazzetti nella parte alta del gambo, prevalentemente capitulati.
GAF non osservati nei tessuti esaminati.Commestibilità e tossicità
Non commestibile.Specie simili
Pholiotina teneroides morfologicamente, potrebbe essere confusa con altre specie del genere Pholiotina dotate di anello, tuttavia il portamento molto esile, le spore, allungate, con parete spessa e poro germinativo ben evidente e i basidi quasi esclusivamente bisporici, ne agevolano la determinazione.
Pholiotina aporos (Kits van Wav.) Clémençon = Conocybe aporos Kits van Wav., specie tipica primaverile, ha gambo scuro, anello ben formato, poro germinativo assente, cheilocistidi capitulati.
Pholiotina aporos var. moseriana Hauskn. si distinguerebbe da Pholiotina aporos var. aporos (Kits van Wav.) Clémençon per il colore completamente bianco, le spore più chiare e l'assenza di GAF (HAUSKNECHT 2009). Non tutti gli autori concordano però per mantenere separate questa due varietà.
Pholiotina arrhenii (Kits van Wav.) Clémençon = Conocybe arrhenii Kits van Wav., presenta spore più grandi e con evidente poro germinativo, si diversifica anche per il periodo di crescita invernale.
Pholiotina vexans (P.D. Orton) Bon = Conocybe vexans P.D. Orton, ha anello ben formato, spore di lunghezza media maggiore di 10,5 µm.
Pholiotina rugosa (Peck) Watling = Pholiotina rugosa (Peck) Singer, ha gambo scuro, anello ben formato, spore a parete spessa, poro germinativo.
Pholiotina hadrocystis (Kits van Wav.) Courtec., ha cheilocistidi di profilo più variabile e poro germinativo piccolo, ma distinto.
Pholiotina vestita (Fr.) Singer, manca dell'anello e ha cheilocistidi mai capitulati.Bibliografia
AA.VV., 2012. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp.
HAUSKNECHT, A., 2009. Conocybe and Pholiotina. Fungi Europaei, Vol 11. Ed Candusso.
TÓTH, A., HAUSKNECHT, A., KRISAI-GREILHUBER, I., PAPP, T., VÁGVÖLGYI, C. & LÁSZLÓ G.N., 2013. Iteratively Refined Guide Trees Help Improving Alignment and Phylogenetic Inference in the Mushroom Family Bolbitiaceae. PLoS ONE 8(2). DOI 10.1371/journal.pone.0056143.Scheda di proprietà AMINT realizzata da Giovanni Galeotti - Approvata e Revisionata dal CLR Micologico di AMINT.
Regione Umbria; Dicembre 2022.
(Exsiccatum GG221201-01)Ritrovamento primaverile su detriti organici, in presenza di aghifoglia e latifoglia.
Foto di Pasquale Lino Sgaravizzi, che era presente al ritrovamento.
Regione Umbria; Dicembre 2022; Foto di Mario Iannotti.
Stazione consolidata e verificata microscopicamente.


Foto di microscopia di Giovanni Galeotti.
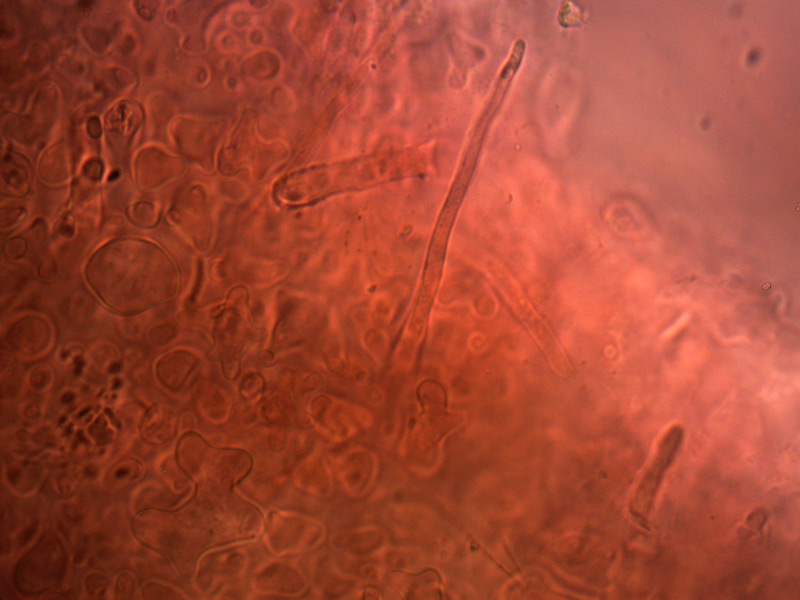
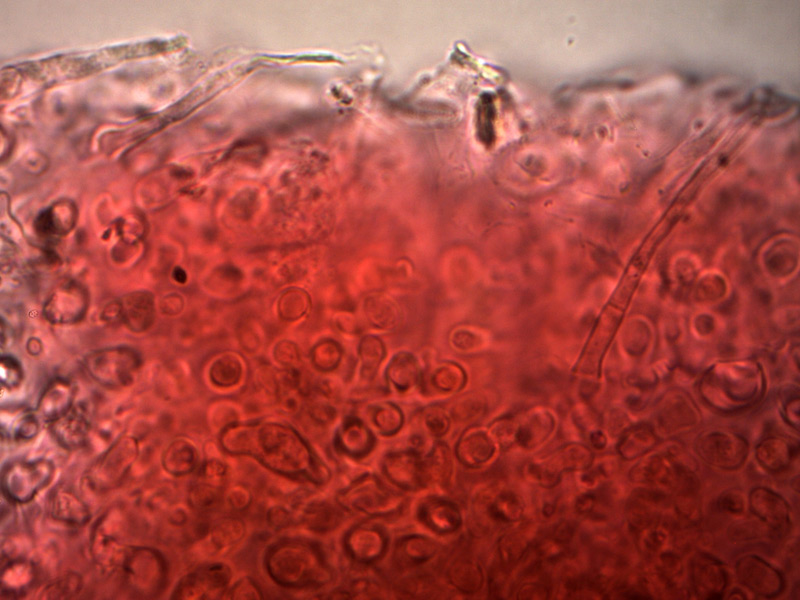
Pileipellis. Osservazione in rosso Congo, a 400×.Cheilocistidi. Osservazione in rosso Congo, a 1000×.
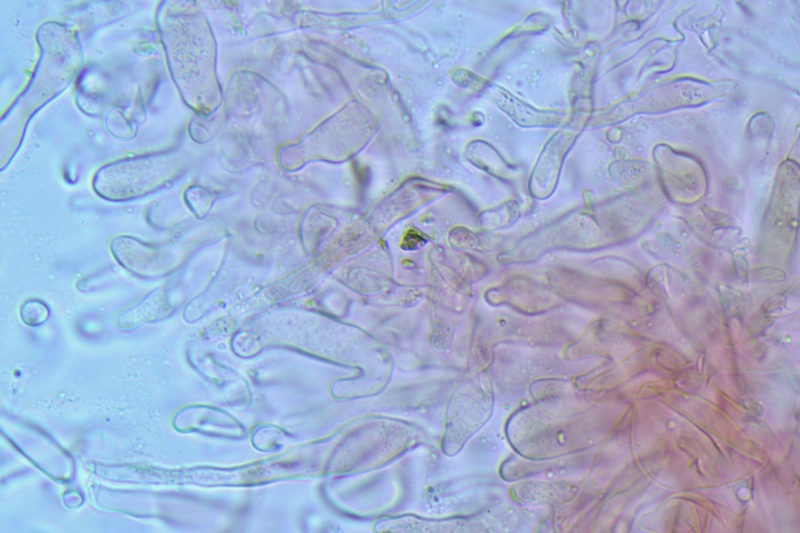
Basidi bisporici. Osservazione in rosso Congo, a 400×.
Basidi bisporici. Osservazione in rosso Congo, a 1000×.
Spore. Osservazione in acqua, a 400×.
Spore (10,6) 10,8-12,1 (15,3) × (5,1) 5,4-6,3 (7,2) µm; Q = (1,6) 1,8-2,1 (2,2); N = 62; Media = 11,5 × 5,9 µm; Qm = 1,9. Osservazione in acqua, a 1000×.
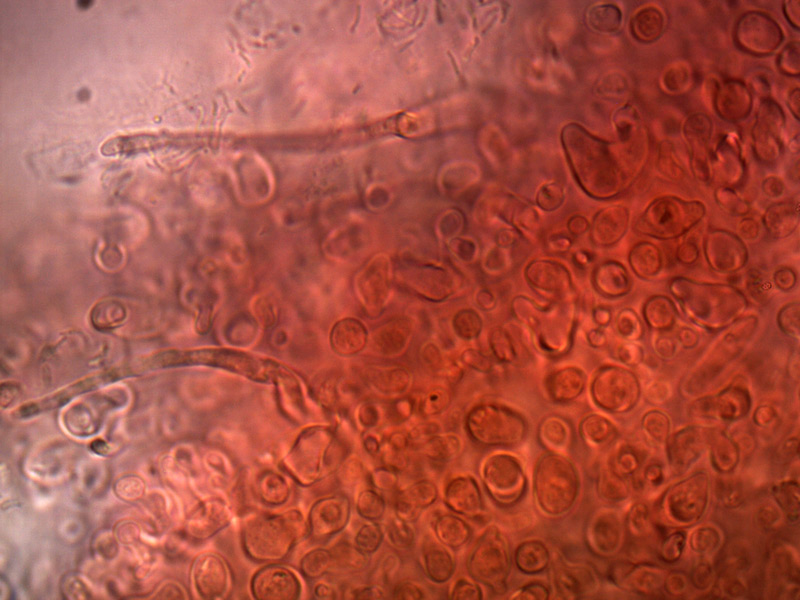
Stipitipellis, costituita da cellule parallele, cilindriche, settate. Osservazione in rosso Congo, a 400×.
Caulocistidi. Osservazione in rosso Congo, a 1000×.
-
-
Phlegmacium chromataphilum (Rob. Henry) Niskanen & Liimat. 2022
Tassonomia
Divisione Basidiomycota
Classe Agaricomycetes
Ordine Agaricales
Famiglia Cortinariaceae
Genere Phlegmacium
Sezione PhlegmacioidesSinonimi
Cortinarius chromataphilus Rob. Henry 1989
Cortinarius sabuletorum Redeuilh & Reumaux 1995
Cortinarius argutipes Bidaud & Reumaux 1996
Cortinarius herculeolens Bidaud 1996Etimologia
L'epiteto Phlegmacium deriva dal greco φλέγμα [phlégma] = mucosità, per la viscosità del cappello.
L'epiteto chromataphilus è composto dal greco χρῶμα [chroma] = colore e dal greco φίλος [fìlos] = amico; quindi amico dei colori.Cappello
Convesso, poi piano-convesso, irregolare a volte fessurato, viscido, di colore biancastro, grigio, violaceo da giovane, marrone con toni giallastri a maturità, fibrilloso, con minute tracce di residui velari biancastri.Lamelle
Strette, abbastanza fitte, seghettate, di colore crema, beige con filo più chiaro.Gambo
Cilindrico, ricoperto da fioccosità biancastre, con base clavata.Carne
Bianca, spessa, soda, imbrunisce lentamente. Odore terroso.Reazioni macrochimiche
KOH sulla carne giallo oro, aranciato.Habitat
Latifoglie, in particolare con Quercus spp., Carpinus betulus, e Tilia cordata.Microscopia
Spore (9,8) 10,3-12,1 (12,3) × (5,7) 5,9-6,7 (6,8) µm; Q = (1,6) 1,7-1,9 (2,0); Media = 11,2 × 6,4 µm; Qm = 1,8; a forma di mandorla, con moderata verrucosità.Commestibilità e tossicità
Non commestibile.Note tassonomiche
Cortinarius chromataphilus appartiene sia morfologicamente che molecolarmente alla Sezione Phlegmacioides e ivi insieme alle due specie Phlegmacium durus (P.D. Orton) Niskanen & Liimat. e Phlegmacium caesiocolor (Kytöv., Liimat. & Niskanen) Niskanen & Liimat. appartiene al (sotto)clade Durus. (SCHMIDT-STOHN et al. 2016) Il sequenziamento del tipo (LIIMATAINEN et al. 2014) ha dimostrato che Cortinarius argutipes Bidaud & Reumaux, Cortinarius herculeolens Bidaud e Cortinarius sabuletorum Redeuilh & Reumaux sono identici a Phlegmacium chromataphilum.Specie simili
Questa specie si caratterizza per la superficie del cappello viscida negli esemplari giovani, le lamelle crema beige, il gambo asciutto, cilindrico, leggermente clavato, non marginato, gambo e carne che al tocco virano al bruno.
Phlegmacium balteatocumatile (Rob. Henry ex P.D. Orton) Niskanen & Liimat., come Phlegmacium chromataphilum non ha sfumature di blu sulle lamelle e ha lo stesso odore. In Phlegmacium chromataphilum e Phlegmacium balteatocumatile, sfumature di blu si trovano solo sul velo universale e nella cuticola del cappello. Si distingue per la mancanza del viraggio e per la differente reazione giallo chiaro al KOH.
Bibliografia
LIIMATAINEN, K., NISKANEN, T., DIMA, B., KYTÖVUORI, I., AMMIRATI, J.F. & FRØSLEV, T. G., 2014. The largest type study of Agaricales species to date: bringing identification and nomenclature of Phlegmacium (Cortinarius) into the DNA era, Persoonia, 33: 98-140.
LIIMATAINEN, K., KIM, J.T., POKORNY, L., KIRK, PM., DENTINGER, B. & NISKANEN, T., 2022. Taming the beast: a revised classification of Cortinariaceae based on genomic data. Fungal Diversity, 112: 89-170.
SCHMIDT-STOHN, G., SAAR, G., BRANDRUD, T.E. & BÁLINT, D., 2016. Interessante Phlegmacium-Funde um Urbino. Journal des J.E.C., 18: 77-96.Scheda di proprietà AMINT realizzata da Tomaso Lezzi e Mario Iannotti - Approvata e Revisionata dal CLR Micologico di AMINT.
Regione Toscana; ottobre 2022; Foto e microscopia di Mario Iannotti.
1° Comitato scientifico M.te Amiata e M.te Rufeno 2022Particolare delle lamelle con tagliente seghettato e filo più chiaro.
KOH sulla carne giallo oro.
Spore (9,8) 10,3-12,1 (12,3) × (5,7) 5,9-6,7 (6,8) µm; Q = (1,6) 1,7-1,9 (2,0); Media = 11,2 × 6,4 µm; Qm = 1,8, a forma di mandorla, con moderata verrucosità. Osservazione in rosso Congo ammoniacale, a 1000×.
-
-
Mycenella rubropunctata Boekhout 1985
Tassonomia
Divisione Basidiomycota
Classe Agaricomycetes
Ordine Agaricales
Famiglia TricholomataceaeEtimologia
L'epiteto Mycenella è un diminutivo che deriva dal genere Mycena dal greco, μύκης [mýces] = fungo, attinente i funghi.
L'epiteto rubropunctata è composta da rubro che deriva dal latino ruber, -ra, -rum = rosso e punctata che deriva da punctatus, a, um = pungo, pungere, punteggiato, per la caratteristica colorazione delle lamelle, punteggiate di rosso.Cappello
Conico campanulato, poi aperto mai disteso, con umbone prominente, la cuticola è liscia e ricoperta da una sottile pruina biancastra che si dissolve a maturazione, le colorazioni variano dal bruno olivastro fino al marrone ocraceo, il margine esterno si presenta eccedente e striato per trasparenza, con colori attenuati sul bordo che è sottile e fimbriato.Lamelle
Da sinuose a ventricose, spesse, intervenate, piuttosto spaziate, uncinate, subdecorrenti, alternate a brevi lamellule. Colore di fondo bianco grigiastro nei giovani soggetti, crema ocraceo a maturità, evidenzia puntinature e macule rossastre caratteristiche di questa specie.Gambo
Cilindrico leggermente sinuoso, bianco grigiastro, completamente rivestito da pruina bianca, assume nella parte intermedia e in quella basale tonalità rossastre, che si accentuano con la manipolazione, il gambo è leggermente dilatato alle estremità, alla base ingloba notevoli quantità di detriti organici.Carne
Di consistenza esigua, privo di odori particolari, sapore dolce.Habitat
Fruttifica nel periodo autunno-invernale, prevalentemente su terreno calcareo sotto Pinus nigra J.F. Arnold, in abbondante substrato di muschio e lettiera di aghi.Microscopia
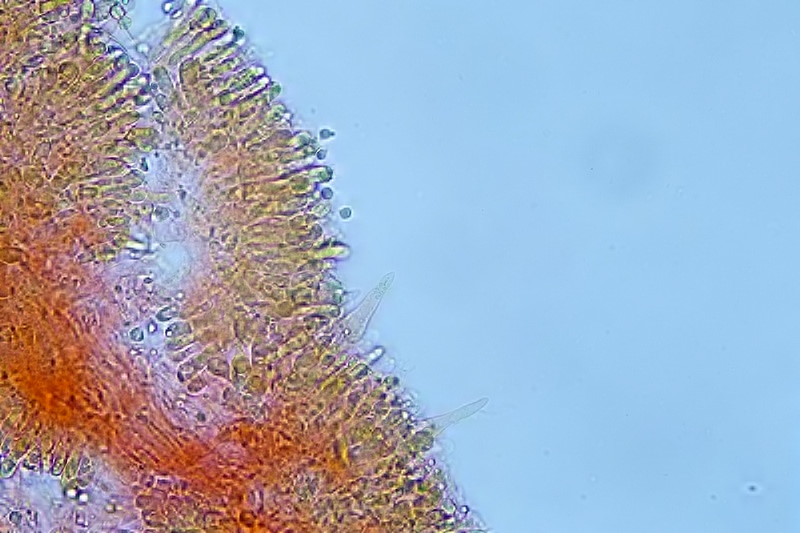
Pileipellis la cuticola nella parte esterna è rivestita da un sottile strato di gel, ed è costituita da ife diverticolate, sinuose, nodulose, di varie forme e dimensioni con una struttura coralloide.
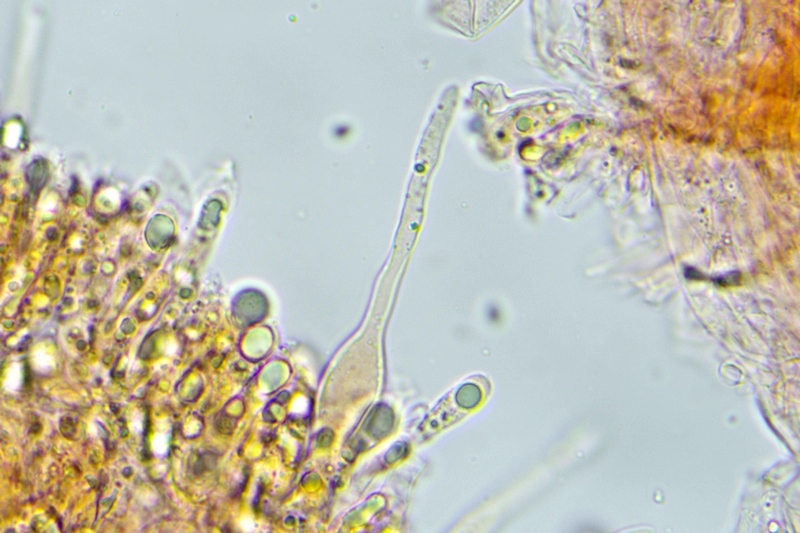
Pileocistidi settati, sinuosi, sublanceolati, lageniformi con apice capitulato.
Cheilocistidi molto abbondanti, principalmente lageniformi, ma anche subfusiformi e cilindracei, capitulati o mucronati, alcuni presentano incrostazioni, che ne rivestono la parte alta o quella mediana.
Pleurocistidi simili ai cheilocistidi.
Basidi clavati, in prevalenza tetrasporici.
Spore (5,3) 5,4-6,7 (7,0) × (1,4) 5,0-6,2 (6,7) µm; Q = (1,0) 1,02-1,2 (1,3); N = 42; Media = 6,1 × 5,6 µm; Qm = 1,1; ialine, inamiloidi, subglobose con verruche nodulose e grosso apicolo.
Stipitipellis costituita da sottili ife parallele.
Caulocistidi abbondanti cilindrici, subfusiformi, capitulati, ma anche simili ai cistidi imeniali.
GAF osservati in tutti i tessuti.Commestibilità e tossicità
Non commestibile.Note Tassonomiche
Il subgenere Mycenella viene elevato a rango di genere nel 1914 da J.E. Lange e comprende entità saprofite di piccole dimensioni caratterizzate da una crescita su residui di lettiera frammisti a terriccio, direttamente su terreno nudo o muschi o su residui legnosi marcescenti, sporadicamente anche su piante ancora viventi o residui vegetali in decomposizione. Il cappello presenta una fittissima pruina bianca nei giovani esemplari. Il rivestimento pileico è caratterizzato microscopicamente dalla presenza di pileocistidi (MUSUMECI, 2014).Specie simili
Il genere Mycenella comprende diverse specie con habitus micenoide, tutte poco comuni, in Europa vengono segnalate sette-dieci specie a seconda delle fonti considerate.
Mycenella margaritifera (Maire) Maas Geest. e Mycenella salicina (Velen.) Singer presentano spore lisce.
Mycenella variispora Robich presenta spore variabili (inde nomen), eterogenee, sia lisce che verrucose.
Mycenella margaritispora (J.E. Lange) Singer, ha cistidi con escrescenze coralloidi semplici o ramificate.
Mycenella bryophila (Voglino) Singer ha cheilocistidi e pleurocistidi lageniformi, con apice ottuso e basidi bisporici.
Mycenella trachyspora (Rea) Bon è la specie più affine morfologicamente e microscopicamente, le differenze sono da ricondurre alla diversa conformazione dei cheilocistidi e pleurocistidi più longilinei e con apice acuto, mai mucronati, e all'assenza delle caratteristiche puntinature e macule rossastre sul filo lamellare e sulle facce. Alcuni autori sinonimizzino Mycenella rubropunctata con Mycenella trachyspora (Rea) Bon, sostenendo che i caratteri distintivi non siano sempre presenti in tutte le raccolte. Certamente sarebbe auspicabile che indagini molecolari approfondite, chiarissero definitivamente questo aspetto.Bibliografia
AA.VV., 2012. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp.
MUSUMECI, E., 2014. Due interessanti specie del genere Mycenella (J.E. Lange) Singer: M. salicina (Velen.) Singer e M. rubropunctata Boekhout. 10
RMR 92, Anno XXX, 2014 (2): 10-20.Scheda di proprietà AMINT realizzata da Giovanni Galeotti, Mario Iannotti e Tomaso lezzi - Approvata e Revisionata dal CLR Micologico di AMINT.
Regione Umbria; Dicembre 2022; Foto e microscopia di Giovanni Galeotti.
(Exsiccatum GG221218-01)Uno dei caratteri fondamentali per determinare la specie, osservato in tutte quattro le raccolte effettuate a poca distanza l'una dall'altra, è la presenza di macule e puntinature rossastre sul filo e sulla faccia delle lamelle, nonché alla base del gambo dopo manipolazione.
Si segnala il ritrovamento di questa bella specie, di cui non ci risultano al momento altri ritrovamenti italiani. Sono stati effettuate osservazioni su quattro campioni, provenienti da raccolte effettuate nello stesso habitat a distanza di alcuni giorni. Le foto e la microscopia fanno riferimento al primo ritrovamento del 22 dicembre 2022.Particolare del margine cappello.
Imenoforo, si notano le macule e puntinature rossastre, meglio evidenti se osservati con la lente, sul filo e sulle facce di alcune lamelle.
Pileipellis. Textura formata da ife diverticolate, disposte come tessere di un puzzle. Osservazione in rosso Congo, a 400×.
Ife della pileipellis ramificate e settate, con escrescenze coralloidi. Osservazione in rosso Congo, a 400×.
Cheilocistidi. Osservazione in rosso Congo, a 400×.
Cheilocistidi. Osservazione in rosso Congo, a 1000×.
Pleurocistidi. Osservazione in rosso Congo, a 400×.
Pleurocistidi. Osservazione in rosso Congo, a 1000×.
Basidi tertasporici. Osservazione in rosso Congo, a 1000×.
GAF alla base dei basidi. Osservazione in rosso Congo, a 1000×.
Spore. Osservazione in floxina, a 400×.
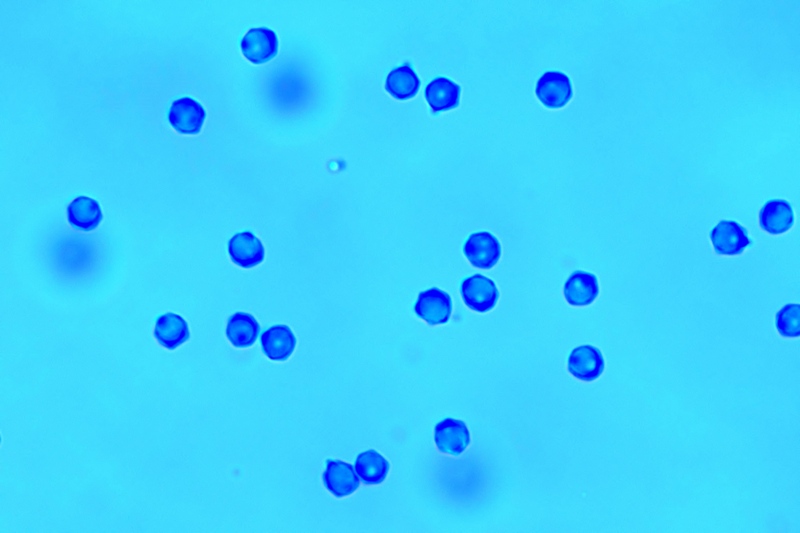
Spore (5,3) 5,4-6,7 (7,0) × (1,4) 5,0-6,2 (6,7) µm; Q = (1,0) 1,02-1,2 (1,3); N = 42; Media = 6,1 × 5,6 µm; Qm = 1,1.
Osservazione in floxina, a 1000×.Spore. Osservazione in acqua, a 1000×.
Spore. Osservazione in blu cotone in acido lattico, a 1000×.
Stipitipellis. Osservazione in rosso Congo, a 1000×.Caulocisti. Osservazione in rosso Congo, a 400×.
Caulocisti. Osservazione in rosso Congo, a 1000×.
-
Galerina vittiformis (Fr.) Singer; Aprile 2016; Foto di Mario Cervini.

-
Pholiotina mediterranea Siquier & Salom 2018
Tassonomia
Divisione Basidiomycota
Classe Agaricomycetes
Ordine Agaricales
Famiglia BolbitiaceaeEtimologia
L'epiteto Pholiotina è un termine composto dal nome di genere Pholiota e dal suffisso -ina = piccolo, per il suo aspetto simile a una piccola Pholiota.
L'epiteto mediterranea è in relazione allo specifico habitat della stessa, ossia l'area del Mediterraneo.Cappello
5-15 mm, da emisferico ad appianato, margine lievemente lobato e sinuoso, negli esemplari giovani con presenza di residuo di velo biancastro, cuticola igrofana, leggermente feltrata, brevemente scanalata nella zona marginale, beige-brunastra, bruno-giallastra negli esemplari giovani, zona discale leggermente più scura.Lamelle
Adnate o leggermente smarginate, spaziate, presenza di lamellule lievemente ventricose, colore da giallo-brunastro chiaro a bruno, tagliente crenulato, eterocromo ed eteromorfo.Gambo
10-35 × 0,5-1,5 mm, cilindrico, flessuoso, pruinoso soprattutto nella zona superiore, lievemente ritorto, inizialmente biancastro specialmente nella parte alta, bianco-giallastro, bruno-giallastro, in vetustà mostra annerimenti allo sfregamento, talvolta sono presenti fibrille grigie argento, con base arrotondata.Anello
Sottile, situato sul terzo superiore dello stipite, striato sulla faccia superiore, con margini sfrangiati, talvolta rotto, le colorazioni vanno da beige chiaro a giallastro, infine bruno per deposito sporale.Carne
Molto esigua, scura, da bruno-giallastra a nerastra alla base dello stipite, odore non significativo, sapore lievemente amarognolo, astringente dopo un po’ dall’assaggio.Habitat
Su dune stabili ricoperte di muschio in prossimità di Pistacia lentiscus, Juniperus communis e Pinus halepensis.Microscopia
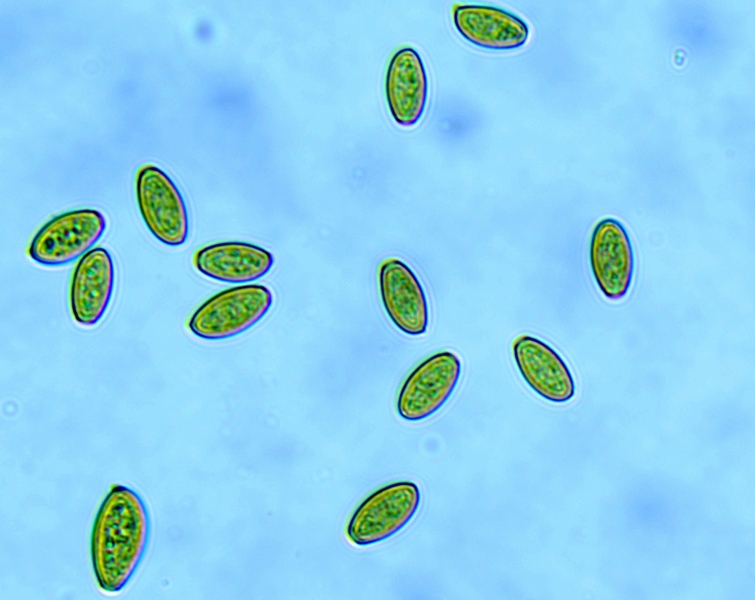
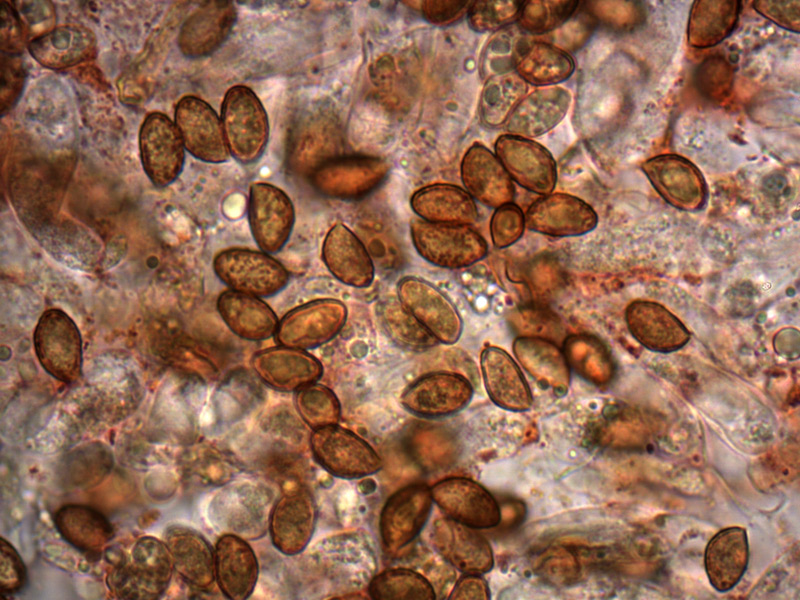
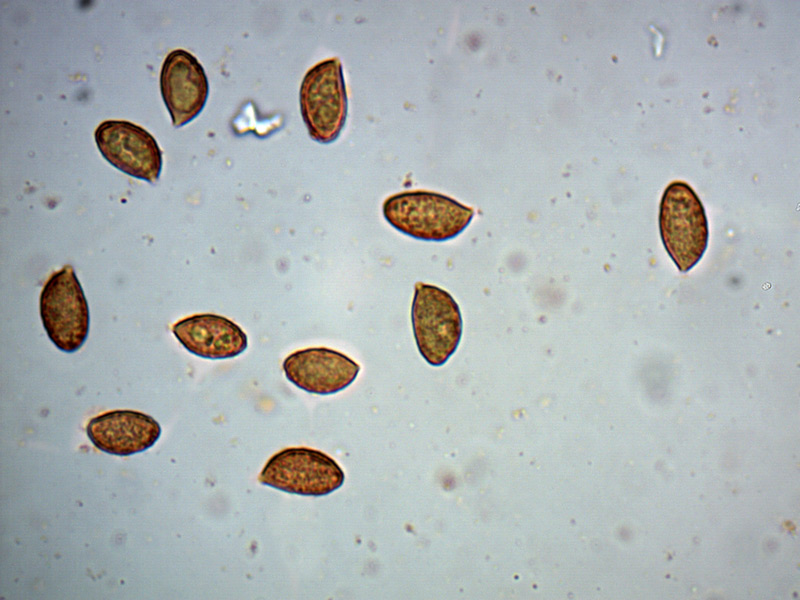
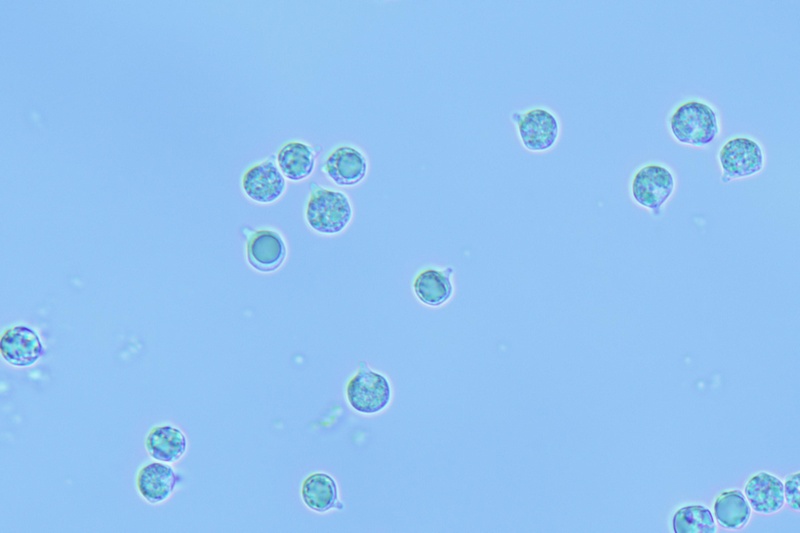
Spore (8,3) 8,6-9,5 (10,1) × (4,6) 5-5,7 (5,9) μm; Q = 1,6-1,8 (2,1); N = 30; media = 9 × 5,3 μm; da ellissoidali a oblunghe, amigdaliformi, lisce, con parete abbastanza spessa e poro germinativo evidente, di colore giallo ocraceo in acqua, bruno-arancio in KOH al 5%.
Basidi 21-29 × 8-11 μm, prevalentemente tetrasporici.
Giunti a fibbia presenti in tutte le strutture ifali.
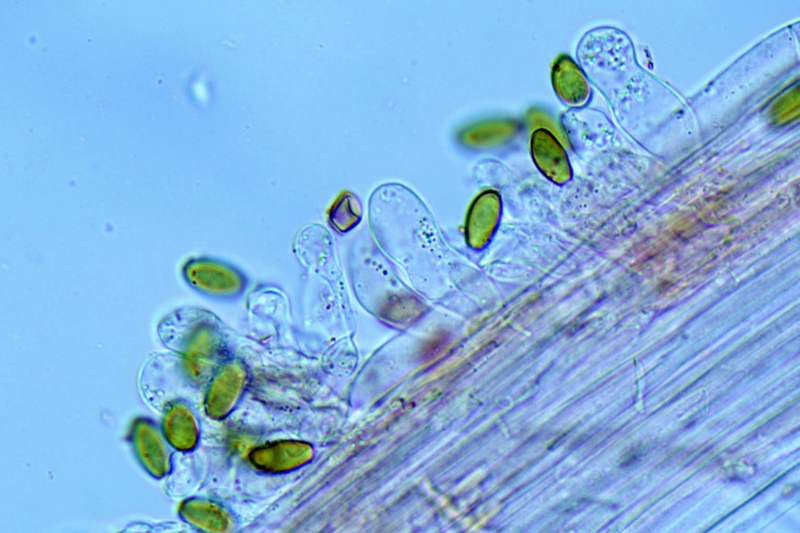
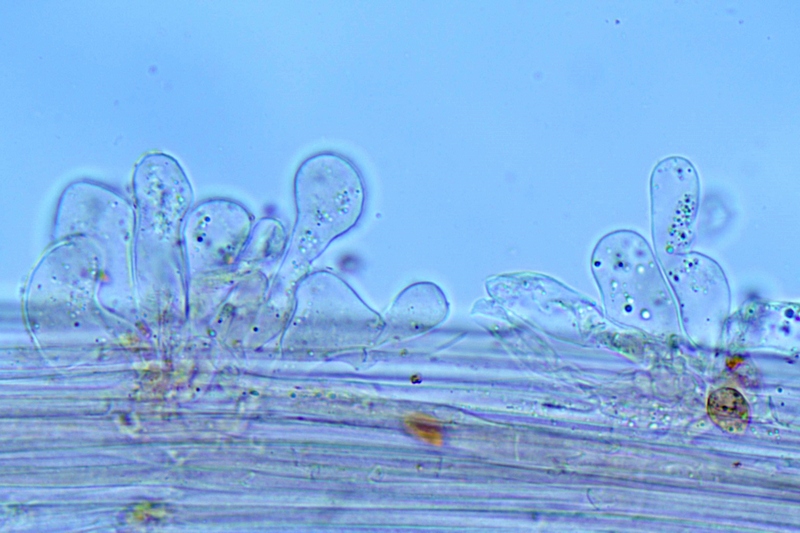
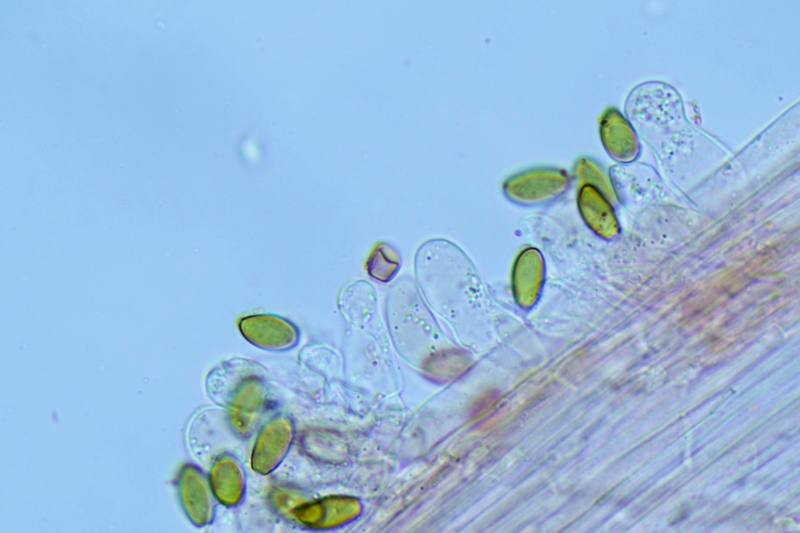
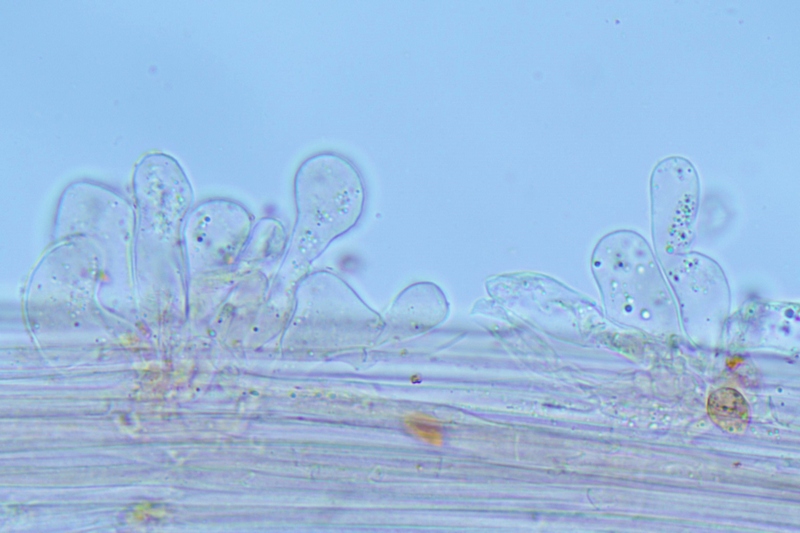
Cheilocistidi (20,3) 23,7-37,8 (39,8) × (6,1) 6,8-10,3 (15) μm; N = 30; media = 30,3 × 8,9 μm; polimorfi: lageniformi, sublageniformi, capitulati, subcapitulati, moniliformi, subglobosi, utriformi.
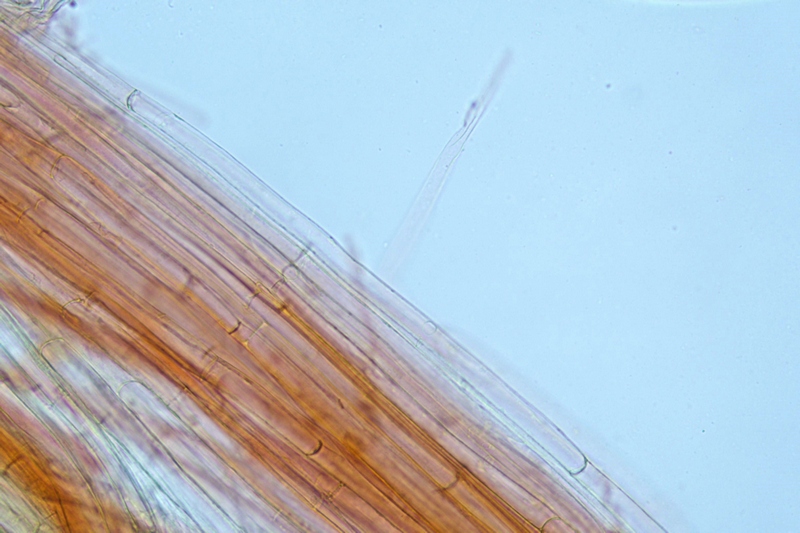
Suprapellis 18-32 × 9-18 μm, di tipo imeniforme, ricoperta da uno strato gelatinoso ad alta rifrangenza.
Subpellis costituita da ife cilindriche, alcune che terminano con apice dilatato e arrotondato.
Caulocistidi (30,9) 31,1-54,9 (58,5) × (7,7) 7,8-14 (15) μm; N = 30; media = 42,6 × 10,3 μm; simili ai cheilocistidi, alcuni con pareti incrostate.Commestibilità e tossicità
Non commestibile.Specie simili
Psathyrella sphagnicola (Maire) J. Favre, si differenzia per il colore della sporata in massa (iantinosporea) e per la presenza dei pleurocistidi.
Pholiotina arrhenii (Kits van Wav.) Clémençon = Conocybe arrhenii Kits van Wav, con cappello e gambo ocra-brunastro, e spore più piccole, cheilocistidi cilindrici con apice arrotondato.
Pholiotina aporos (Kits van Wav.) Clémençon = Conocybe aporos Kits van Wav, specie primaverile, anello ben definito, assenza di poro germinativo.
Pholiotina teneroides (J.E. Lange) Singer, si differenzia per avere basidi bisporici.
Pholiotina utricystidiata Enderle & H.-J. Hübner = Conocybe utricystidiata (Enderle & H.-J. Hübner) Somhorst, cheilocistidi prevalentemente utriformi.
Pholiotina vexans (P.D. Orton) Bon = Conocybe vexans P.D. Orton, Cheilocistidi da subcilindrici a lageniformi, leggermente sinuosi con spore più grandi.
Pholiotina rugosa (Peck) Watling = Pholiotina rugosa (Peck) Singer, spore a parete spessa, poro germinativo molto più largo, zona discale del cappello rugosa.Bibliografia
ALBANESE, A., BERNA, C., BORAGINE, M., FERRILLI, V., ORGERA, E., & ZOTTI, M., 2022. Pholiotina mediterranea una rara specie costiero-dunale. Rivista di Micologia 65 (3): 25-37.
SIQUIER, J.L., & SALOM, J.C., 2017. Pholiotina mediterranea sp. nov. Rivista di Micologia 60: 213-236.Scheda di proprietà AMINT realizzata da Antonio Albanese - revisionata da Tomaso Lezzi, approvata dal CLR Micologico di AMINT.
Regione Campania; Gennaio 2022; Foto e microscopia di Antonio Albanese.
Suprapellis, strato gelatinoso esterno. Osservazione in rosso Congo, a 400×.
Suprapellis. Osservazione in rosso Congo, a 400×.
Suprapellis. Osservazione in rosso Congo, a 400×.
Subpellis. Osservazione in rosso Congo a 400×.
Basidio. Osservazione in rosso Congo, a 630×.
Spore. Osservazione in KOH, a 1000×.
Spore. Osservazione in acqua, a 1000×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Cheilocistidi. Osservazione in rosso Congo, a 630×.
Caulocistidi. Osservazione in rosso Congo, a 630×.
Caulocistidi. Osservazione in rosso Congo, a 630×.
Caulocistidi. Osservazione in rosso Congo, a 630×.
-
Regione Trentino-Alto Adige (Provincia Autonoma di Bolzano); Luglio 2021; Foto di Tomaso Lezzi.
(Exsiccatum TL210728-03)Cappello rosa, bordato di bluastro; gambo azzurrato; habitat di zona Alpina.
Cuticola con pigmento rosa, ife rigonfie e terminali rigonfi; lamelle con filo sterile nero-blu o concolore; spore 9-10,5 ×6,5-8 µm, con 5-8 angoli; GAF assenti.
Particolare della squamettatura del cappello.

-
Velenovskya vacini (Velen.) Albanese, Boragine, M. Carbone & P. Alvarado 2022
Tassonomia
Divisione Ascomycota
Classe Pezizomycetes
Ordine Pezizales
Famiglia PezizaceaeEtimologia
L'epiteto Velenovskya è dedicato a Josef Velenovský (22 aprile 1858 - 7 maggio 1949), che per primo descrisse la specie tipo.
L'epiteto vacini é dedicato da Velenovský al suo amico Václav Vacek.Sinonimi
Plicariella vacini Velen. 1939
Peziza vacini (Velen.) Svrcek 1977Ascoma
Si presenta sotto forma di apotecio sessile, gregario, discoide, irregolare, fino a 22 mm di diametro, da appiattito a più o meno convesso, superficie esterna con sfumature verdastre.Imenoforo
Liscio, cerebriforme, con colorazioni che vanno dal marrone chiaro al marrone nocciola scuro, con sfumature violacee.Stroma
Consistenza cerosa gelatinosa, fino a 3 mm di spessore, di colore beige, grigio con sfumature violacee, odore e sapore non testati.Microscopia
Spore (12,2) 12,6-14,5 (14,8) × (8,6) 9,7-10,5 (13) µm; Q = (1) 1,2-1,4 (1,6); N = 30; Media = 13,5 × 10,6 µm; Qm = 1,3; misure effetuate da sporata in massa, ornamentate da verruche ottuse a piramidali simili ad ali grossolane e spesse, alte 1,5-2,7 μm, che a volte si fondono per creare uno pseudoreticolo, ialine poi giallo-brunastre, in gran parte ellissoidali, monoguttulate ma anche biguttulate.
Aschi 233-252 × 14-16,8 μm, cilindrici, opercolati, leggermente amiloidi per quasi tutta la loro lunghezza, amiloidia molto più marcata in alto, tipo Wt secondo VAN VOOREN (2020).
Parafisi 6,1-13,5 μm di diametro, cilindriche, settate, biforcate in alto, raramente triforcate, con apici da clavati a lanceolati, capitulati, immerse in una matrice gelatinosa di colore brunastro chiaro.
Subimenio sottile, costituito da una fitta textura intricata di ife.
Excipulum medullare superiore 14,6-25 μm di diametro, con pareti fino a 0,5 μm di spessore, a textura intricata subialina, ife cilindriche, disposte parallelamente sulla superficie imeniale.
Excipulum medullare inferiore 7,7-12,6 μm di diametro, composta da cellule da piriformi a arrotondate; 33,3-56,5 μm di diametro, con pareti fino a 0,7 μm di spessore, a textura globulosa, formato da ife cilindriche settate e intrecciate.
Excipulum ectale 128-23,5 μm di diametro a textura angularis, composto da ife emergenti, settate.Habitat
Su terreno prevalentemente sabbioso e siliceo (acido), con crescita su resti carbonizzati di Pinus halepensis.Commestibilità e tossicità
Sconosciuta, potenzialmente non commestibile, come altre specie simili.Specie simili
La morfologia dell'ascoma, la crescita antracofila e le ornamentazioni sporali di questa specie fanno sì che sia difficile confonderla con altre specie.Note nomenclaturali
Il nome corretto di questa specie è Velenovskya vacini e non Velenovskya vacinii come Velenovský lo dedicò al suo amico Vacek, latinizzato in Vacinus, quindi l'ortografia corretta è vacini.
Per approfondimenti vedi l'articolo di ALBANESE et al. (2022) Velenovskya, a new genus in the family Pezizaceae to accommodate Plicariella, dove è presente una ricca bibliografia sulla specie.Bigliografia
ALBANESE, A., BORAGINE, M., CARBONE, M., & ALVARADO, P., 2022 Velenovskya, a new genus in the family Pezizaceae to accommodate Plicariella. Ascomycete.org, 14 (3) : 109–115. DOI: 10.25664/ART-0353.
VAN VOOREN, N., 2020 Reinstatement of old taxa and publication of new genera for naming some lineages of the Pezizaceae (Ascomycota). Ascomycete.org, 12(4): 179-192. DOI: 10.25664/art-0305.Scheda di proprietà AMINT realizzata da Antonio Albanese, Marcello Boragine, e Matteo Carbone - revisionata da Tomaso Lezzi, approvata dal CLR Micologico di AMINT.
Regione Lazio; Gennaio 2022; Foto di Antonio Albanese.
Gli esemplari sono stati raccolti in inverno (gennaio) durante un'escursione sul litorale “Domitio” (Campania, Italia),con temperatura di 13 °C (85% di umidità), terreno molto umido, prevalentemente sabbioso e siliceo (acido). L'ascoma è cresciuto su abbondanti resti carbonizzati di Pinus halepensis, ai margini di un'area di 50 metri quadrati completamente allagata dalla pioggia.
Spore. Osservazione in acqua, a 630×.
Spore. Osservazione in acqua, a 1000×.
Spore. Osservazione in blu cotone acido lattico, a 1000×.
Aschi e parafisi. Osservazione in rosso Congo, a 630×.
Regione Lazio; Gennaio 2022; Foto di Marcello Boragine.
Aschi e parafisi. Osservazione in rosso Congo, a 630×.Aschi e spore. Osservazione in blu cotone acido lattico, a 630×.
Regione Lazio; Gennaio 2022; Foto di Antonio Albanese.
Aschi e spore. Osservazione in blu cotone acido lattico, a 630×.Aschi amiloidi. Osservazione in melzer, a 630×.
Asco. Osservazione in rosso Congo, a 630×.
Parafisi. Osservazione in rosso Congo, a 630×.
Parafisi biforcate. Osservazione in rosso Congo, a 630×.
Sezione apotecio. Dal basso a salire osserviamo: Excipulum ectale, excipulum medullare inferiore, excipulum medullare superiore, subimenio, aschi e parafisi. Osservazione in rosso Congo, a 100×.
-
Lepiota helveola Bres. 1882
Tassonomia
Divisione Basidiomycota
Classe Basidiomycetes
Ordine Agaricales
Famiglia AgaricaceaeEtimologia
L'epiteto Lepiota deriva dal greco λεπίς [lepis] = squama e ὠτίον [oûs, otós] = orecchio, per la somiglianza con un orecchio squamoso.
L'epiteto helveola deriva dal latino dal diminutivo di hélvus = giallo, biondo, per il colore del cappello.Cappello
Cappello fortemente squamettato, che lascia intravedere la carne bianca tra le squame, soprattutto negli esemlari maturi. Il centro del cappello è più scuro per le squame tutte appressate e risulta marrone scuro.Lamelle
Lamelle libere bianche, con filo concolore, frastagliato, presenti numerose lamellule. Sporata bianca.Gambo
Gambo cilindrico, giallo, con anello più scuro del gambo, e fioccosità lanuginosa marrone al di sotto dell'anello.Carne
Bianca.Commestibilità e Tossicità
Velenoso mortale.Bibliografia
AA.VV., 2012. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp.
BON, M., 1999. Les Lepiotes. Flore Mycologique d’Europe. Vol. 3. Lille: Ed. Association d'Ecologie et de Mycologie.
CANDUSSO, M. & LANZONI, G., 1990. Lepiota s.l. Fungi Europæi. Vol. 4. Saronno: Libreria editrice Giovanna Biella.Scheda di proprietà AMINT realizzata da Tomaso Lezzi - Approvata e Revisionata dal CLR Micologico di AMINT.
Regione Lazio; Novembre 2008; Foto di Tomaso Lezzi.
Ritrovamento effettuato in un prato con presenza di pini, cipressi e pioppi.



-
Sowerbyella fagicola J. Moravec 1973
Tassonomia
Divisione Ascomycota
Classe Pezizomycetes
Ordine Pezizales
Famiglia PyronemataceaeEtimologia
L'epiteto Sowerbiella è stato dedicato al naturalista inglese James Sowerby (1757-1882).
L'epiteto fagicola deriva dal latino Fagus = faggio, in riferimento all'habitat elettivo con Fagus sylvatica.Ascoma
Apotecio a forma di coppa lungamente stipitato, diametro di 15-17 mm, con un’altezza di 30-40 mm, profondamente cupulato, con margine regolare. Imenoforo liscio di color arancio, superficie esterna non liscia, ma leggermente verrucosa, concolore o appena più chiara.Carne
Ceracea, fragile, leggermente più chiara della superfice esterna, non si evidenziano cambiamenti di colore alla manipolazione, né odori particolari.Microscopia
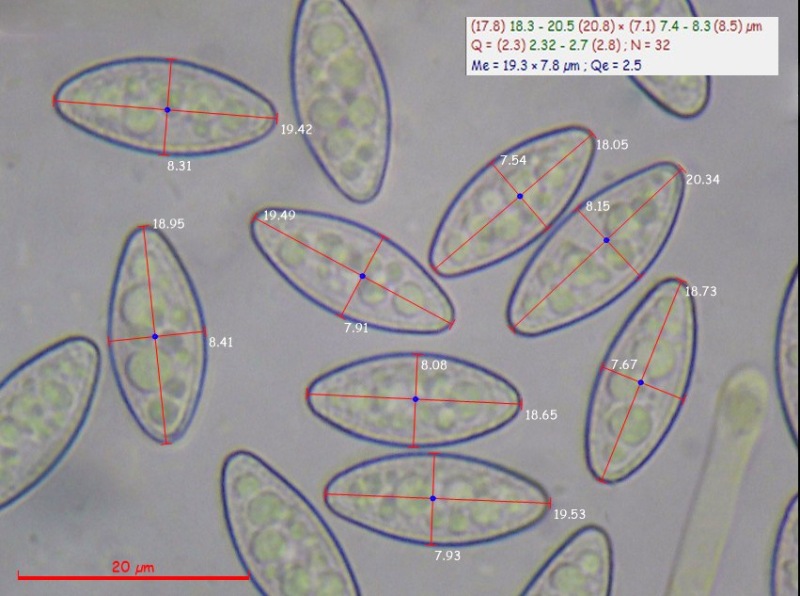
Spore (17,8) 18,3-20,5 (2,8) × (7,1) 7,4-8,3 (8,5) µm; Q = (2,3) 2,3-2,7 (2,8); N = 32; Media = 19,3 x 7,8 µm; Qm = 2,5; ellissoidali, subfusoidi, che contengono 3-4 guttule più grandi con altre di dimensione più piccole, a maturità finemente verrucose, ialine, uniseriate nell’asco.
Aschi 205-240 x 7-13 µm, cilindracei, ottasporici, non amiloidi, con base pleurorinca.
Parafisi 2,5-4 µm di larghezza, filiformi, settate.
Subimenio poco differenziato, simile all'excipulum medullare ma più denso, con cellule larghe 3-6 µm, ialine, con pareti sottili.
Excipulum medullare a tessitura intricata, con ife larghe 5-9 µm, ialine, con pareti sottili.
Excipulum ectale a tessitura globoso-angolare, composto da cellule globose, doliformi o poligonali di 13-30 µm di diametro, con pareti ialine , diametro 5-8 µm.Habitat
In gruppi di esemplari ravvicinati, ma non cespitosi, su terreno ricco di detriti legnosi interrati, in ambiente igrofilo, spesso in presenza di Quercus pubescens, Quercus cerris, Corylus avellana e Ulmus minor, specie quindi non esclusiva di faggio, come potrebbe far immaginare il nome. Viene descritta come specie autunnale ma può essere rinvenuta anche in inverno.Commestibilità e tossicità
Non commestibile.Osservazioni
Molti autori concordano nel ritenere che si tratti di una specie poco comune, essendo stata rinvenuta in poche occasioni nei paesi Europei.Specie simili
Sowerbyella imperialis (Peck) Korf, presenta ornamentazioni delle spore simili, ma più piccole.
Sowerbyella rhenana (Fuckel) J. Moravec, ha spore più piccole, con un reticolo completo, stipite bianco e parafisi ricurve.
Sowerbyella radiculata ( Sowerby) Nannf. ha spore ornamentate da un reticolo parziale.
Aleuria aurantia (Pers.) Fuckel, ha una colorazione simile, assenza di stipite, con spore reticolate a maglie più o meno poligonali.Bigliografia
BREITENBACH J. & KRANZLIN F., 1981. Champignons de Suisse, Tome 1: les ascomycètes.
LE GAL M., 1947. Recherches sur les ornementations sporales des Discomycètes operculés. Thèse. Ann. Sc. Nat. Bot. 11 (8): 73-297.
MEDARDI G., 2006. Ascomiceti d'Italia: 267-269.
MORAVEC J., 1973. Sowerbyella fagicola J. Moravec spec. nov., nový druh z Československa. Česká Mykologie 27 (2): 65-68.
MORAVEC J., 1985. A Taxonomy revision of the genus Sowerbyella Nannfeldt (Discomycetes, Pezizales) Mycotaxon 23: 483-496.
PADOVAN F., LORENZON L., CAMPO E., FLORIANI M., MICHELIN L., BROTZU R., BIZIO E. & MAGNOZZI M., 2020. 1260 Funghi della provincia di Belluno.
KAJEVSKA I. & SAVIĆ D., 2019. First record of Neolecta vitellina (Bres.) Korf & J. K. Rogers and Sowerbyella fagicola J. Moravec from Serbia. Biologica Nyssana 10 (1): 1-8
YAO Y.-J. & SPOONER B.M., 2006. Species of Sowerbyella in the British Isles, with validation of Pseudombrophila sect. Nannfeldtiella (Pezizales). Fungal Diversity 22: 267-279.Scheda di proprietà AMINT realizzata da Dino Cannavicci, Loredana Battisti e Matteo Bevilacqua - Revisionata da Tomaso Lezzi, approvata dal CLR Micologico di AMINT.
Regione Lazio, Rignano Flaminio (RM). Gennaio 2023. Foto di Dino Cannavicci.
In gruppi di esemplari ravvicinati, ma non cespitosi, su terreno ricco di detriti legnosi interrati, in ambiente igrofilo, spesso in presenza di Quercus pubescens, Quercus cerris, Corylus avellana e Ulmus minor, specie quindi non esclusiva di faggio, come potrebbe far immaginare il nome. Anche se viene descritto come fungo autunnale il nostro ritrovamento è avvenuto l'8 gennaio 2023.
Spore. Osservazione in acqua, a 1000×. Foto di Loredana Battisti.
Spore. Osservazione in acqua, a 1000×.
Spore, si evidenzia la superficie finemente pruinosa. Osservazione in acqua, a 1000×.
Aschi. Osservazione in acqua, a 400×.
Base dell'asco asco pleurorinca. Osservazione in acqua, a 400×.
Parafisi. Osservazione in acqua, a 1000×.
Excipulum ectale. Osservazione in acqua, a 400×.
Excipulum medullare. Osservazione in acqua, a 400×.
-
Resupinatus niger (Schwein.) Murrill; Regione Lazio; Novembre 2019; Foto di Tomaso Lezzi.
Ritrovamento su legno di Quercia.



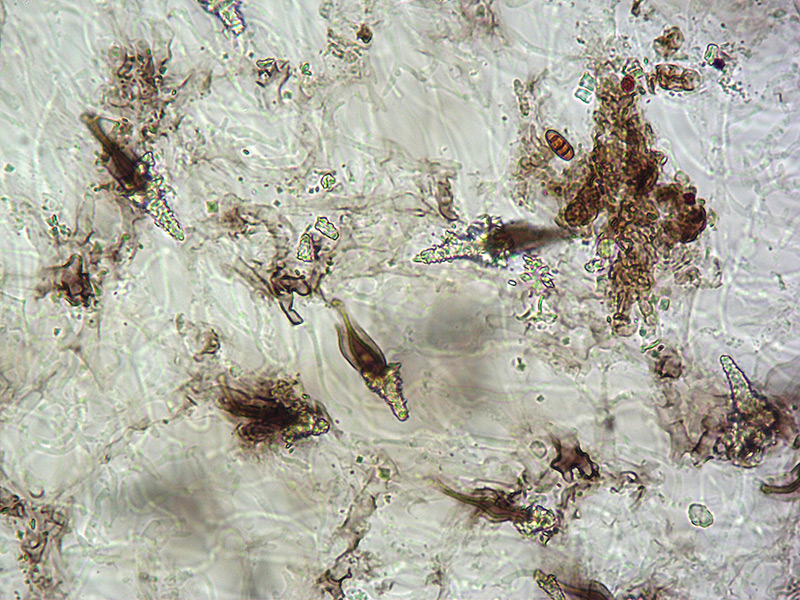
Trama lamella. Osservazione in L4, a 40×.
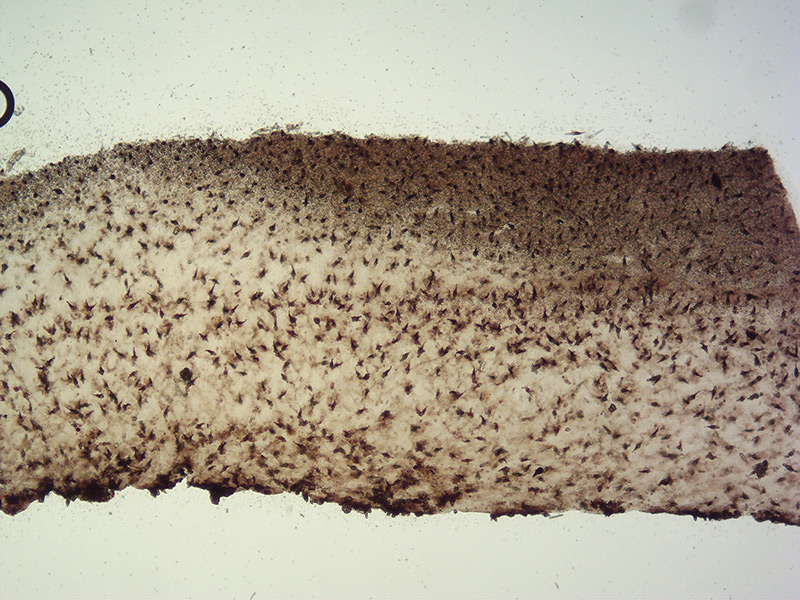
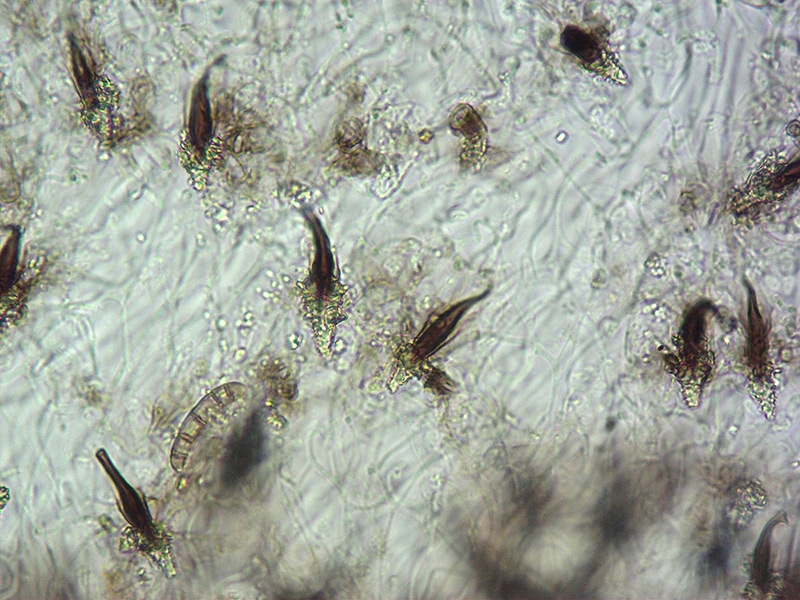
Cheilocistidi incrostati. Osservazione in L4, a 100×.
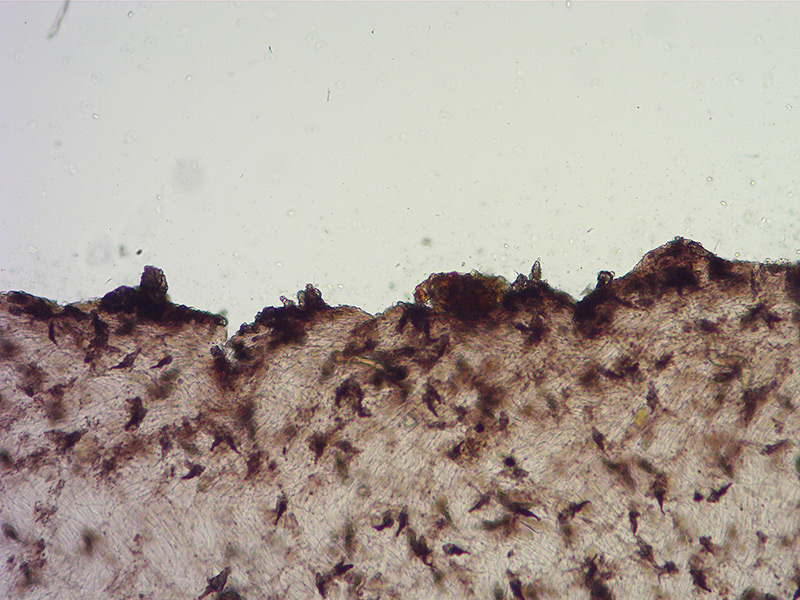
Cheilocistidi incrostati. Osservazione in L4, a 400×.


Pleurocistidi incrostati. Osservazione in L4, a 400×.
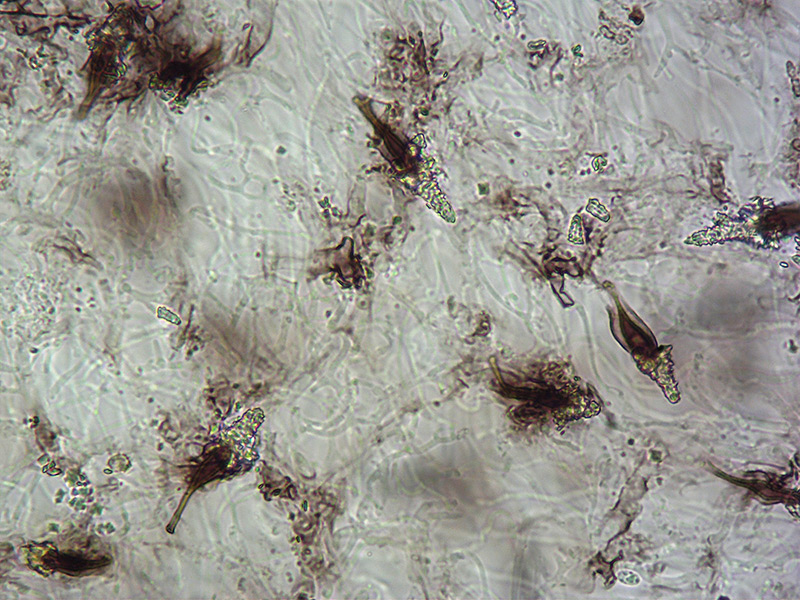
Spore. Osservazione in L4, a 400×.
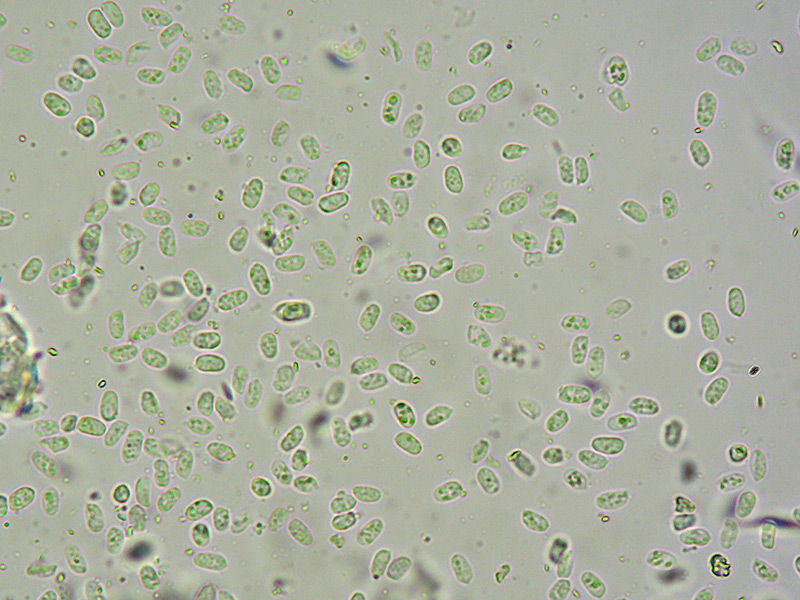
Spore. Osservazione in L4, a 1000×.
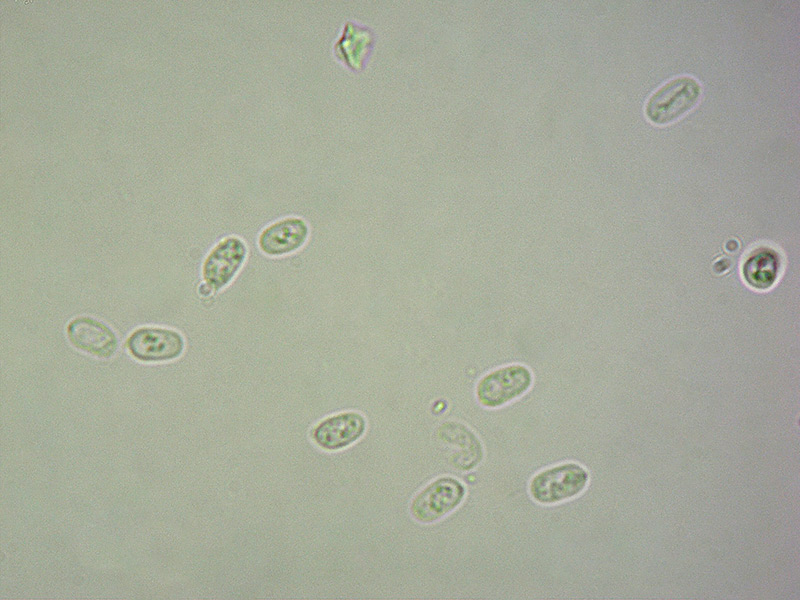
-
Resupinatus niger (Schwein.) Murrill; Regione Lazio; Dicembre 2019; Foto di Tomaso Lezzi.
Ritrovamento su legno di Quercia.





Sporata bianca effettuata su vetrino.

-
Resupinatus niger (Schwein.) Murrill 1915
Tassonomia
Divisione Basidiomycota
Classe Agaricomycetes
Ordine Agaricales
Famiglia TricholomataceaeSinonimi
Pleurotus niger (Schwein. : Fr.) Sacc. 1887
Hohenbuehelia nigra (Schwein. : Fr.) Singer 1951
Hohenbuehelia latialis Angeli & Contu 2008Etimologia
L'epiteto Resupinatus deriva dal latino rĕsŭpīnus = piegato all'indietro, capovolto.
L'epiteto niger deriva dal latino nĭgĕr = nero.Sporoforo
Sessile, attaccato dorsalmente al substrato, lamellato a forma di conchiglia, consistenza gelatinosa, 7-8 mm di diametro, di color nero, con feltro irsuto di color grigio-ocraceo e di aspetto "poroide", sempre più consistente e spesso verso l’attaccatura.Imenoforo
Lamelle nere, rade, spesse, disposte a ventaglio, convergenti verso l’attaccatura al substrato, intercalate da lamellule.Carne
Gelificata, nerastra. Odore e sapore non significativi.Habitat
Su tronco di latifoglia, isolati o in piccoli gruppi.Microscopia
Pileipellis totalmente immersa nel gel. La parte più esterna evidenzia ife cilindriche, erette, ixotricoderma, agglutinate dal gel a formare ciuffi, spesso a forma di cono; quella intermedia mostra ife con una intensa pigmentazione bruno-nerastra; quella inferiore è immersa in uno spesso strato di gel con ife ramificate, molto più disperse. Non osservati pileometuloidi, che invece vengono descritti in letteratura da alcuni autori (ALBERTÓ et al. 1998, CONSIGLIO & SETTI 2018a, DEMİRAK & KAYGUSUZ 2021).
Basidi ialini, clavati, tetrasporici.
Spore (5,9) 6,4-7,6 (7,9) × (3,3) 3,8-4,7 (5,2) µm; Q = 1,5-1,8 (2); N = 25; Media = 7 × 4,3 µm; Qm = 1,7; ellissoidali, lisce, guttulate.
Trama lamellare vista in sezione trasversale presenta le ife della parte prossima al filo che si distribuiscono in uno spazio maggiore, risultando meno concentrate e, in tal modo, conferendo alla trama un aspetto "a cucchiaino" (CONSIGLIO & SETTI 2018a), peculiarità esclusiva di Resupinatus niger. La struttura è immersa in gel. Le ife presentano lievi incrostazioni parietali scure.
Cheilocistidi a parete molto spessa (cheilometuloidi), per lo più fusiformi, con apice molto acuto e con base allungata e pigmentata di bruno, ricoperti di granuli cristallini ialini di varie dimensioni, in particolare nella metà superiore, occasionalmente fino alla base. Metacromatici in blu di cresile, destrinoidi con il reattivo di Melzer. Non sono stati osservati altri tipi di cistidi.
Pleurocistidi hanno struttura analoga ai cheilometuloidi, ma sono di dimensioni maggiori.
GAF presenti in tutte le strutture, particolarmente abbondanti nello strato inferiore della pileipellis.Commestibilità e tossicità
Non commestibile.Osservazioni
La presenza di consistente gelatina in tutto lo sporoforo non ha agevolato l’osservazione. In particolare, per quanto riguarda i cistidi imeniali, sono apparsi evidenti soltanto quelli metuloidi, mentre i leptocistidi (cistidi dotati di parete liscia e sottile), descritti in letteratura (CONSIGLIO & SETTI 2018a, CONSIGLIO et al. 2018b), non sono stati osservati.
Non sono stati osservati neppure i pileometuloidi segnalati da più Autori, ma, comunque, considerati da Coker (1944) un carattere poco frequente.Specie simili
Resupinatus niger risulta essere attualmente l’unica specie europea del genere Resupinatus Nees ex Gray che presenta cistidi metuloidi, caratteristica delle specie appartenenti al vicino genere Hohenbuehelia Schulzer.
Resupinatus alboniger (Pat.) Singer, ha pileo da nero a grigio-bruno scuro ma con cheilocistidi non metuloidi, cilindracei e coralloidi. Spore cilindraceo-allantoidi. Pleurocistidi assenti.
Resupinatus europaeus Consiglio & Setti, ha tinte più grigie, cheilocistidi clavati e coralloidi, non metuloidi. Pleurocistidi assenti.
Hohenbuehelia subbarbata (Berk. & M.A. Curtis) Singer, ha pileo nero e lamelle scure ma possiede cistidi metuloidi ialini e spore ellittiche più piccole.Bibliografia
ALBERTÓ E., FAZIO A. & WRIGHT J.E., 1998. Reevaluation of Hohenbuehelia nigra and species with close affinities. Mycologia, 90(1): 142-150. [Data di accesso: 28/02/2023].
ANGELI P. & CONTU M., 2008. Hohenbuehelia latialis sp. nov., una nuova specie resupinata dal Parco Presidenziale di Castelporziano (Lazio, Italia). Micologia e Vegetazione Mediterranea, 22 (2): 119-129.
COKER W.C., 1944. The smaller species of Pleurotus in North Carolina. Journal of the Elisha Mitchell Scientific Society, 6O: 71-95, pl. 40-52.
CONSIGLIO G. & SETTI L., 2018a. I generi Hohenbuehelia e Resupinatus in Europa. Ed. AMB.
CONSIGLIO G., SETTI L. & THORN R.G., 2018b. New species of Hohenbuehelia, with comments on the Hohenbuehelia atrocoerulea–Nematoctonus robustus species complex. Persoonia, 41: 202-212.
DEMİRAK M.Ş.Ş. & KAYGUSUZ O., 2021. Resupinatus niger (Basidiomycota: Agaricales): A rare fungus from Turkey. In Research & Reviews in Agriculture, Forestry and Aquaculture Sciences - I. [Data di accesso: 28/02/2023].
Fonti Internet
KUO M., 2009. Resupinatus alboniger. Mushroomexpert.com. [Data di accesso: 28/02/2023].Scheda di proprietà AMINT realizzata da Laura Nicoletti - Revisionata da Tomaso Lezzi, approvata dal CLR Micologico di AMINT.
Regione Lazio; Gennaio 2023; Foto e microscopia di Laura Nicoletti.
Ritrovamento su tronco a terra di Quercus ilex L. in fase di degradazione, esemplari isolati o in piccoli gruppi.
Pileipellis. Osservazione in acqua, a 100×.
Trama lamella "a cucchiaino", peculiarità di Resupinatus niger. Osservazione in rosso Congo, a 100×.
Ife della trama lamellare a parete incrostata. Osservazione in rosso Congo, a 1000×.
Basidi. Osservazione in rosso Congo, a 1000×.
Cheilocistidi. Osservazione in rosso Congo, a 400×.
Cheilocistidi. Osservazione in Melzer, a 400×.
Cheilocistidi. Osservazione in Melzer, a 1000×.
Pleurocistidi. Osservazione in rosso Congo, a 400×.
Pleurocistidi. Osservazione in rosso Congo, a 600×.
Pleurocistidi. Osservazione in rosso Congo, a 600×.
Pleurocistidi. Osservazione in rosso Congo, a 1000×.
Spore. Osservazione in rosso Congo, a 1000×.
Spore. Osservazione in blu di cresile, a 1000×.
-
-
Thaxterogaster subpurpurascens (Batsch) Niskanen & Liimat. 2022
Tassonomia
Divisione Basidiomycota
Classe Agaricomycetes
Ordine Agaricales
Famiglia Cortinariaceae
Genere Thaxterogaster
Sottogenere Phlegmacium
(Il sottogenere Phlegmacium appartiene al genere Cortinarius da cui sono stati separati alcuni Thaxterogaster. Manteniamo qui anche questa suddivisione per aiutare il lettore ad orientarsi nella sistematica)Sinonimi
Cortinarius purpurascens var. subpurpurascens (Batsch) Fr. 1838
Cortinarius subpurpurascens (Batsch) J. Kickx f. 1867
Phlegmacium subpurpurascens (Batsch) Ricken ex Gaugue 1973Etimologia
L'epiteto Thaxterogaster deriva dal nome proprio del Micologo Rholand Taxter a cui è stato dedicato il genere da Singer e dal termine greco γαστήρ (gastér) = ventre, stomaco.
L'epiteto subpurpurascens è composto dal prefisso latino sub- = simile a e da purpurascens dal latino purpŭrascens = che diventa rosso come la porpora, per il viraggio delle lamelle, simile a quello di Thaxterogaster purpurascens (Fr.) Niskanen & Liimat. = Cortinarius purpurascens Fr.Cappello
Convesso-emisferico, poi convesso ed infine piano-convesso, ma tende a rimanere con il margine leggermente involuto. Fibrilloso, con tonalità grigie, bruno-rossastre, senza toni violetti, se non al bordo del cappello ove manifesta anche una certa igrofanietà.Lamelle
Smarginate, fitte, di colore crema-lilla, poi bruno-violacee, che virano al viola-vinaceo al tatto, sono presenti lamellule di vario ordine.Gambo
Clavato, con base allargata, leggermente bulbosa-appuntita ma con i margini arrotondati, non marginata, presenta un colore di fondo biancastro ed evidenti sfumature violacee. Vira al viola-vinaceo al tatto. Con presenza di micelio biancastro alla base.Carne
Biancastra, con sfumatura viola verso la corteccia del gambo. Vira al viola-vinaceo. Odore mielato.Reazioni macrochimiche
KOH con reazione leggermente color argilla sul pileo, forse dovuta solo al colore della cuticola bagnata dal reagente.Habitat
Latifoglie, in particolare con Quercus spp, Fagus sylvatica, Corylus avelana, e Tilia cordata.Microscopia
Spore (8,7) 8,9-10,0 (10,2) × (5,2) 5,5-6,0 (6,3) µm; Q = (1,5) 1,55-1,7 (1,8); N = 27; Media = 9,3 × 5,8 µm; Qm = 1,6, amigdaliformi, verrucose.Commestibilità e tossicità
Non commestibile.Specie simili
Questa specie si caratterizza per la superficie del cappello viscida negli esemplari giovani, con il gambo asciutto, le lamelle lilla e il gambo clavato, leggermente bulboso, ma non marginato, lamelle, gambo e carne che al tocco virano velocemente al viola.
Cortinarius cyanites Fr. presenta viraggio al rosso vinaceo solo nella carne, ma non sulle lamelle, né sul gambo.
Thaxterogaster porphyropus (Alb. & Schwein.) Niskanen & Liimat. = Cortinarius porphyropus (Alb. & Schwein.) Fr. si distingue per l'habitat di Betula spp., per il gambo più lungamente clavato, per la carne del cappello viola e nella parte superiore del gambo, e biancastra nel resto del gambo.
Thaxterogaster subporphyropus (Pilát) Niskanen & Liimat. = Cortinarius subporphyropus Pilát è anch'esso specie di boschi caldi di latifoglia, presenta cappello con toni violacei e base bulbosa. Microscopicamente presenta spore di lunghezza maggiore di 10 µm.
Thaxterogaster purpurascens (Fr.) Niskanen & Liimat., = Cortinarius purpurascens Fr. presenta anch'esso come i precedenti viraggio al al viola, ma presenta bulbo marginato. Micorscopicamente presenta spore di dimensioni minori, di 8-9 µm di lunghezza.Bibliografia
AA.VV., 2018. Funga Nordica. Agaricoid, boletoid and cyphelloid genera. Ed. Nordsvamp. 2nd Edition, 2nd printing.
CALLEDDA F., CAMPO E., FLORIANI M. & MAZZA R. 2021. Guida Introduttiva al genere Cortinarius in Europa. Ed. Osiride.Scheda di proprietà AMINT realizzata da Tomaso Lezzi e Mario Iannotti - Approvata e Revisionata dal CLR Micologico di AMINT.
Regione Toscana; Ottobre 2022; Foto di Tomaso Lezzi.
1° Comitato scientifico M.te Amiata e M.te Rufeno 2022.Particolare delle lamelle beige crema, che al tocco virano al viola.
Regione Toscana; Ottobre 2022; Foto e microscopia di Mario Iannotti.
1° Comitato scientifico M.te Amiata e M.te Rufeno 2022.KOH con reazione leggermente color argilla sul pileo, forse dovuta solo al colore della cuticola bagnata dal reagente.
Lamelle smarginate, di colore crema-lilla, che virano al violaceo al tatto, sono presenti lamellule di vario ordine.
Spore (8,7) 8,9-10,0 (10,2) × (5,2) 5,5-6,0 (6,3) µm; Q = (1,5) 1,55-1,7 (1,8); N = 27; Media = 9,3 × 5,8 µm; Qm = 1,6, amigdaliformi, verrucose. Osservazione in rosso Congo ammoniacale, a 1000×.
-
Hygrophorus leucophaeo-ilicis Bon & Chevassut; Regione Umbria; Dicembre 2022; Foto di Tomaso Lezzi.
Ritrovamento in bosco di Quercus ilex.
Specie caratterizzata da viraggio al giallo sul fresco e da exsiccatum che assume colori bruno-vinosi. Nella foto in basso sono infatti visibili sul cappello delle aree giallastre.
Specie simili:
Hygrophorus discoideus (Pers.: Fr.) Fr. è associato con conifere, specialmente Picea spp.
Hygrophorus arbustivus Fr. ha fibrille innate sul cappello, non ha viraggio al giallo e da essiccato non assume colori bruno-vinosi. -
-
-
-
-
-
-




.jpg.166708439f14d0fb60e76cd7cdf98ed3.jpg)














.jpg.3bf5e64ba885eee4ec8255c49b00e704.jpg)


.jpg.aa43c283fde87b967b8a227cd8b10023.jpg)




copia.thumb.jpg.1b9ba4919cda71dd99319db84a309b7a.jpg)


copia.thumb.jpg.1cafb50e07dd4d37cfdd4fea7dea2d88.jpg)
.thumb.jpg.fb39616f8449fa5b2ad6dbc4fbd452b0.jpg)
.thumb.jpg.e6810ab563a8270359c04e0d3aa9ef7e.jpg)
.thumb.jpg.ed60046e856175bab818a3eae28c25af.jpg)
.thumb.jpg.aa69f37d028bfc5770256ce7df814138.jpg)

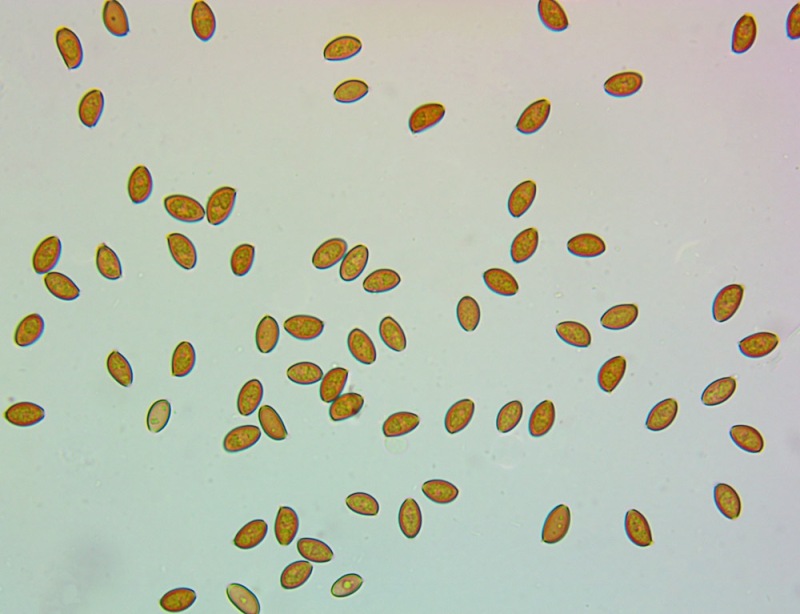
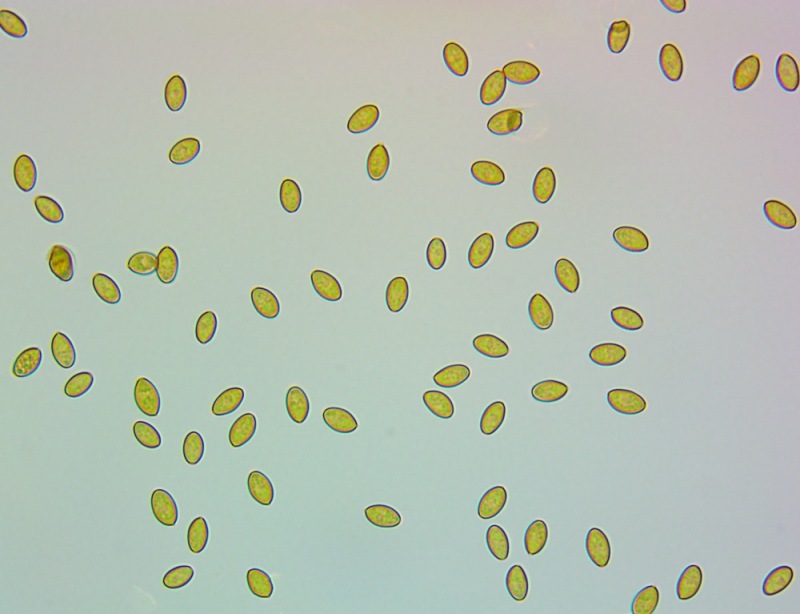
.thumb.jpg.f93713b398bb104329fc78ebcb9c6242.jpg)
.thumb.jpg.379ff7996a15eb7860348d1a9094577a.jpg)
.thumb.jpg.017d5369d6f11c100ad0cb633c6b785f.jpg)
.thumb.jpg.25058e68ff4eb4c06ded409214a66ae4.jpg)
.thumb.jpg.8cbc59cf5ce1cf24a49369a40698d1be.jpg)
.thumb.jpg.89bef96d4f7aef1d0149dba30a83ee5a.jpg)
.thumb.jpg.7bfef74311937be1778f5b84211224f1.jpg)
.thumb.jpg.8c0412286abe8baaaab0cdea59f0d8e1.jpg)
.thumb.jpg.5d8589d4e3bae0c682bd4c4a2846ffdd.jpg)
.thumb.jpg.e4f689ddd95ba55bf866551d8ed27f87.jpg)
.thumb.jpg.c32938b058c6a840c12c93600e20d2d7.jpg)
.thumb.jpg.421a729a2dcc6e4ba73ded823cd57386.jpg)
-2.thumb.jpg.739acebc0efb7e120692a523877f28af.jpg)
.thumb.jpg.d70a58bb05366e927d3a0521d4fd8b3c.jpg)
.thumb.jpg.919473d29e2f155f05363d281294abbb.jpg)
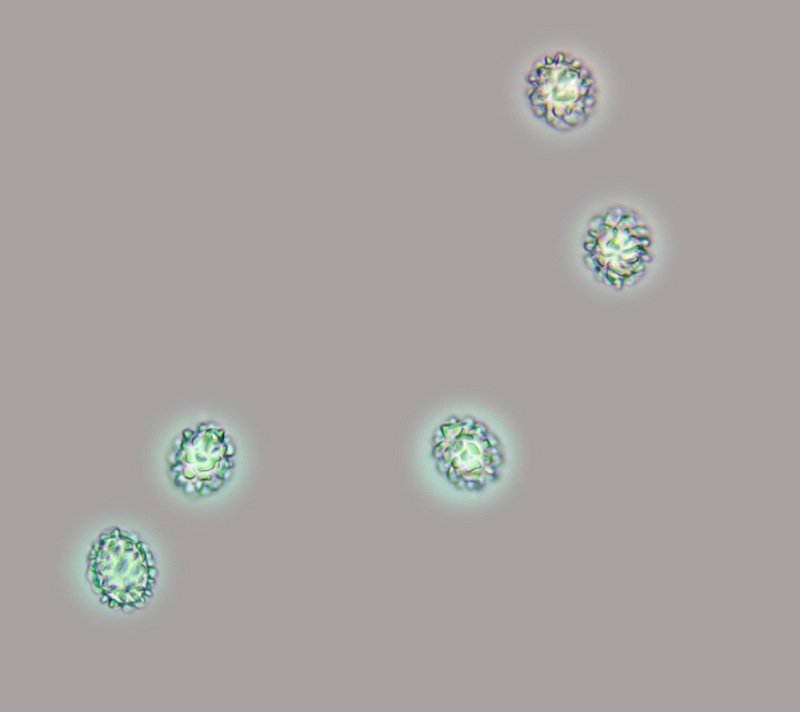
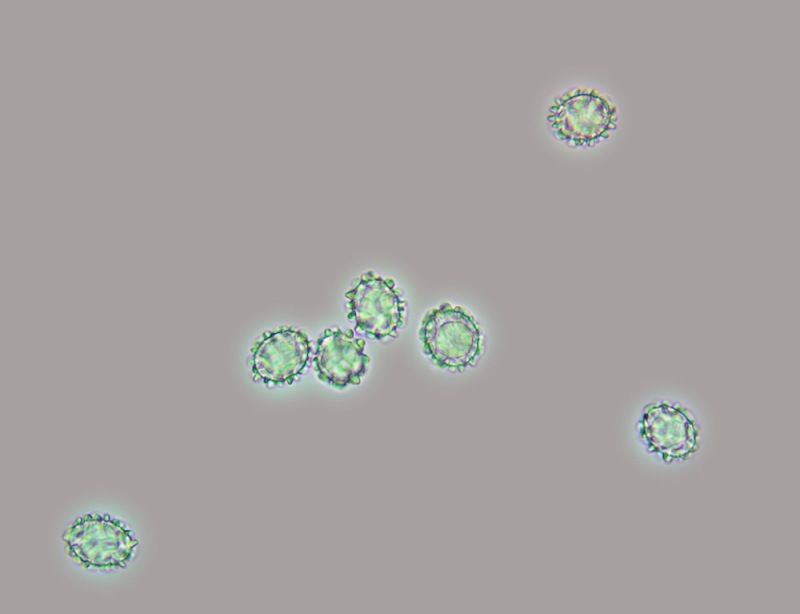


.thumb.jpg.9d66e80200f43274074470256da83cb5.jpg)

.thumb.jpg.d00495cec2bfcb19b2a2736d88d8d098.jpg)
.thumb.jpg.3404b33689bb29ffcbbc56f5eaf0761e.jpg)

.thumb.jpg.920820f737f81d91a8d3e5e7b20e9dd5.jpg)



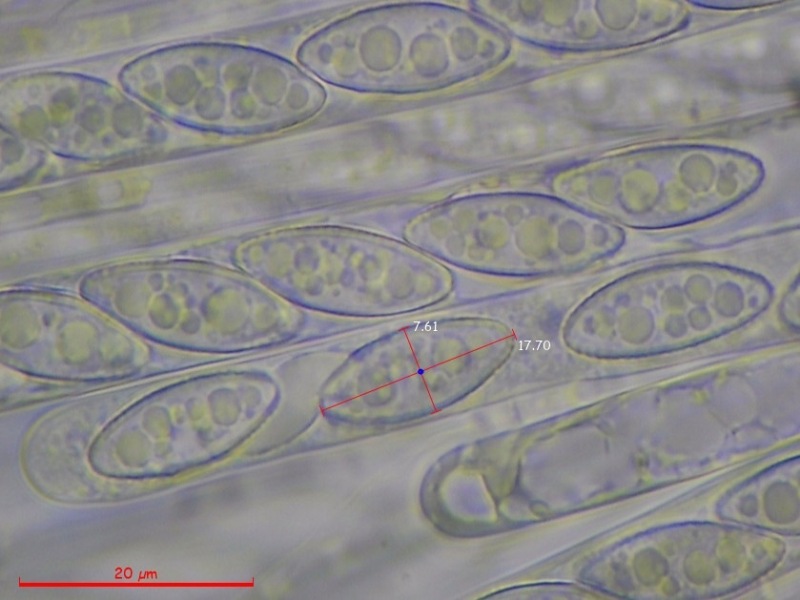
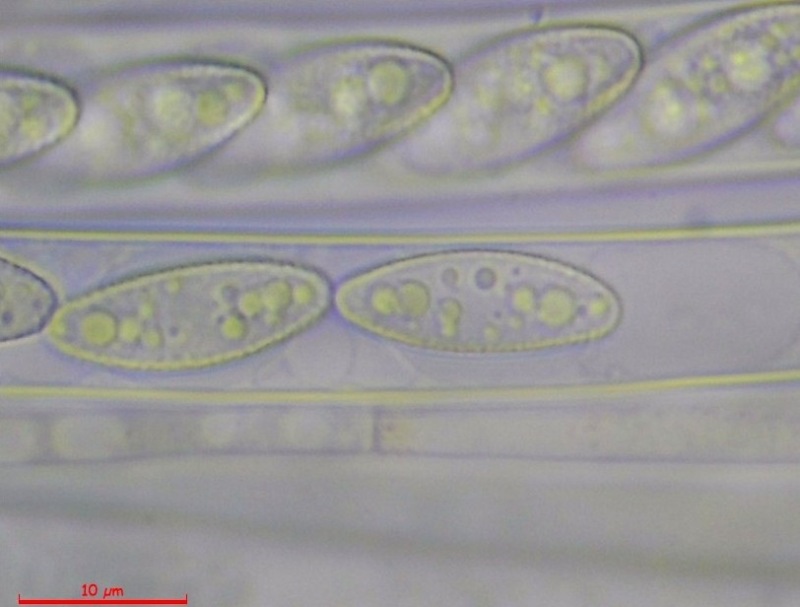
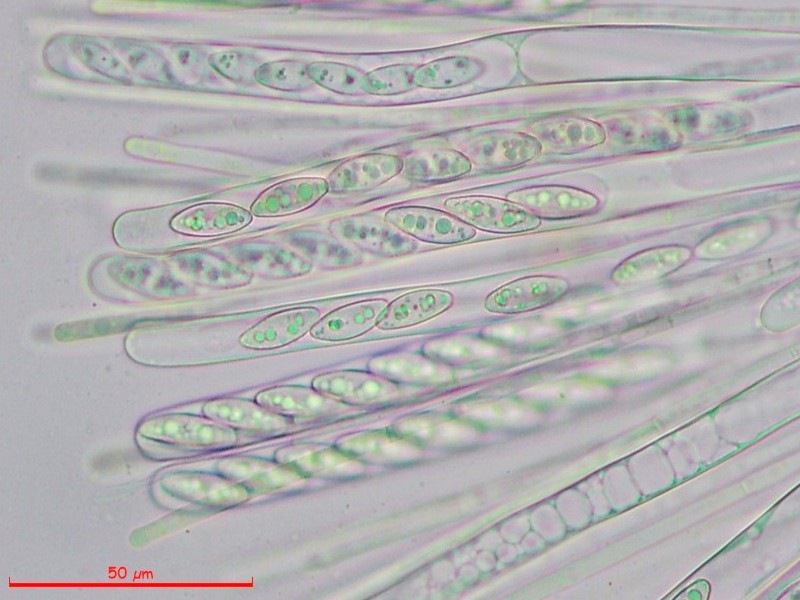
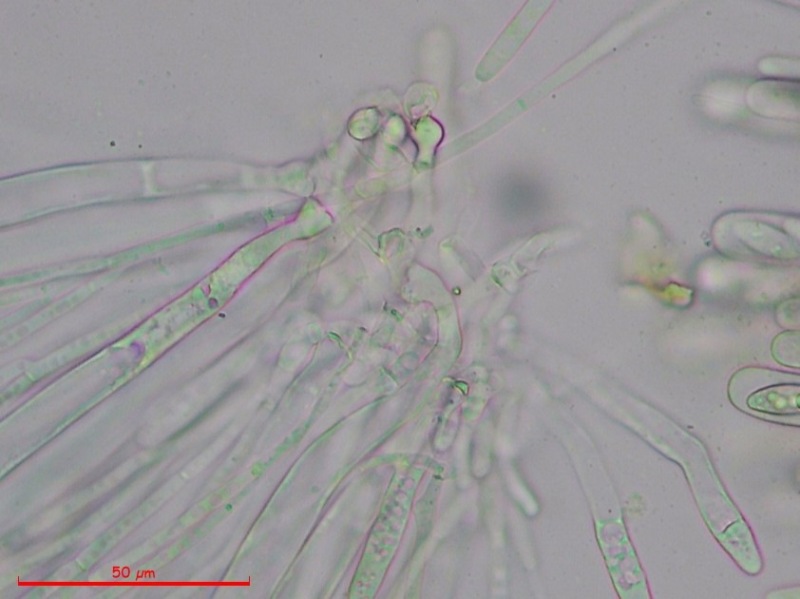

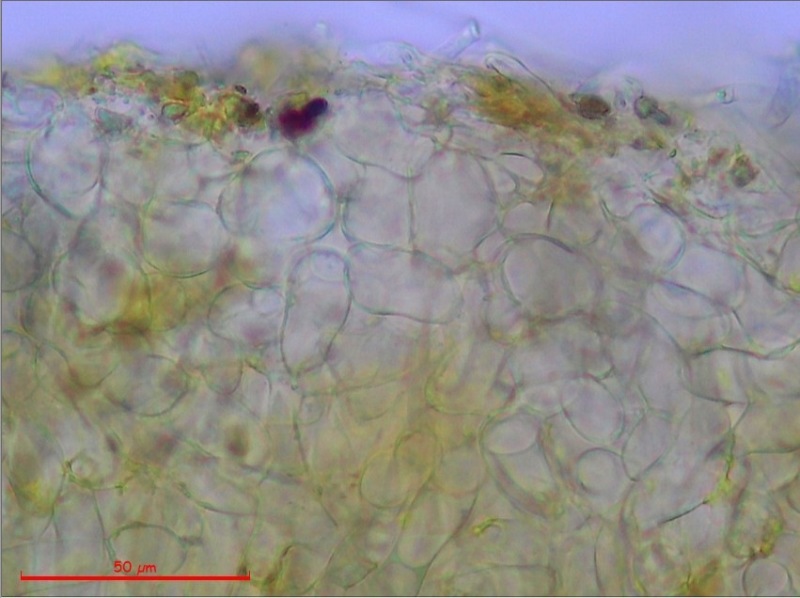
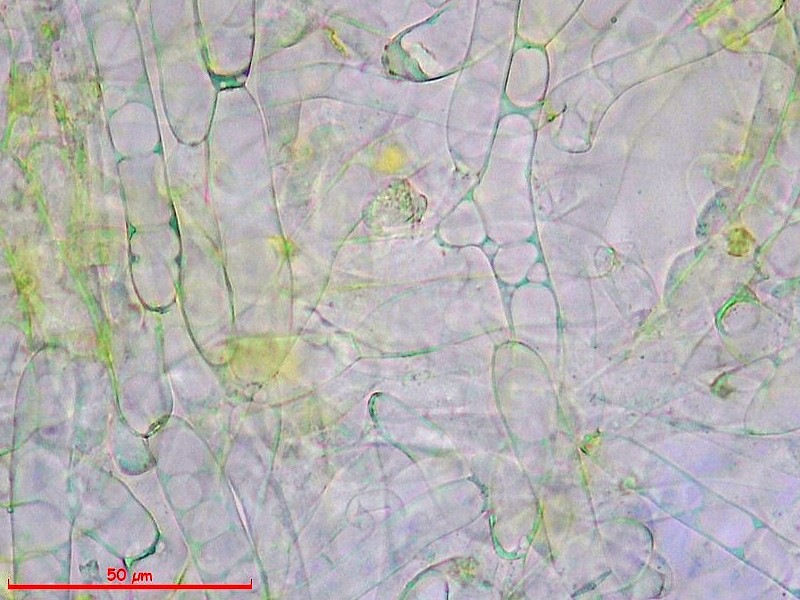
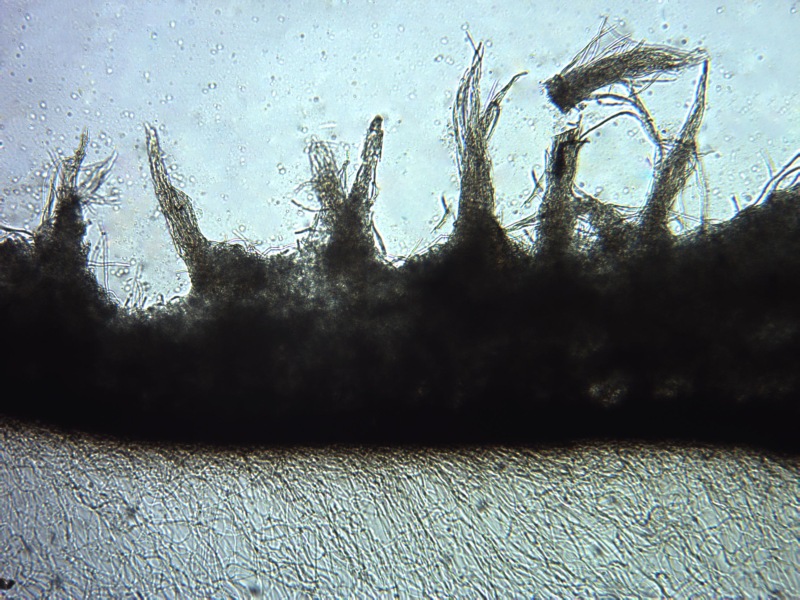
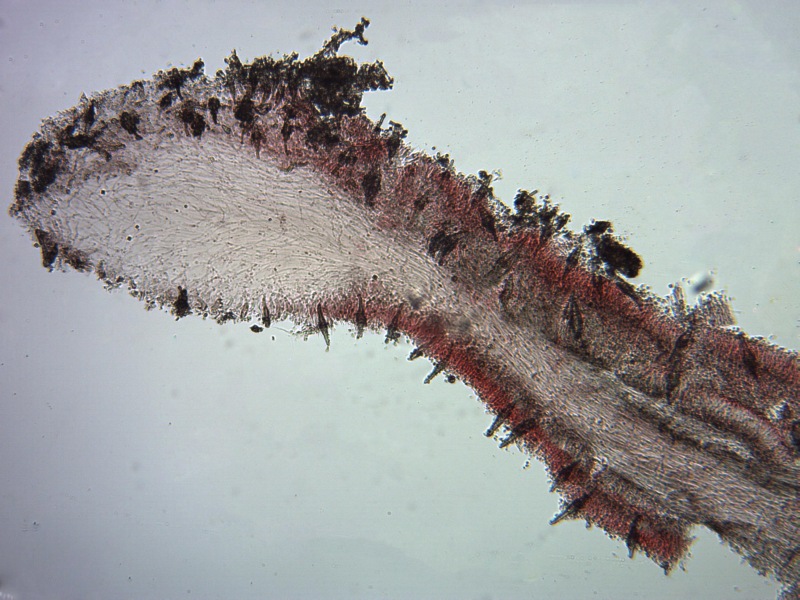
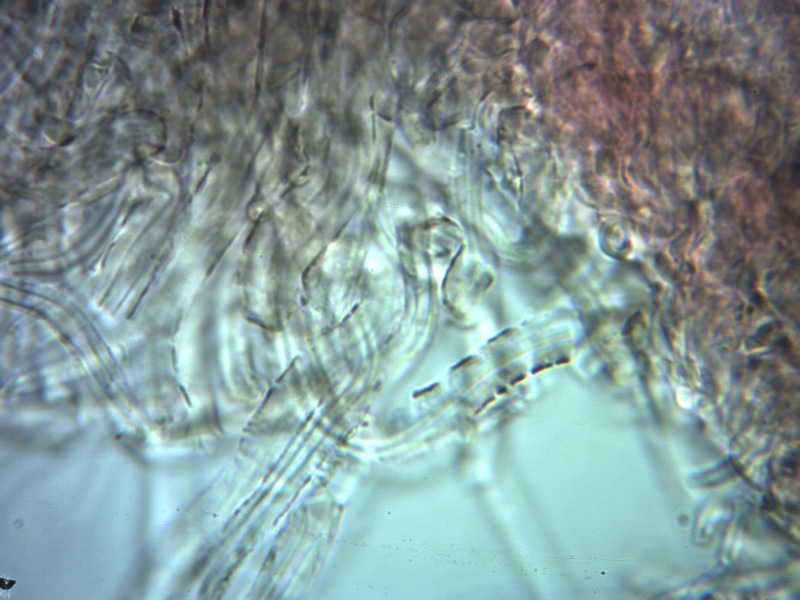
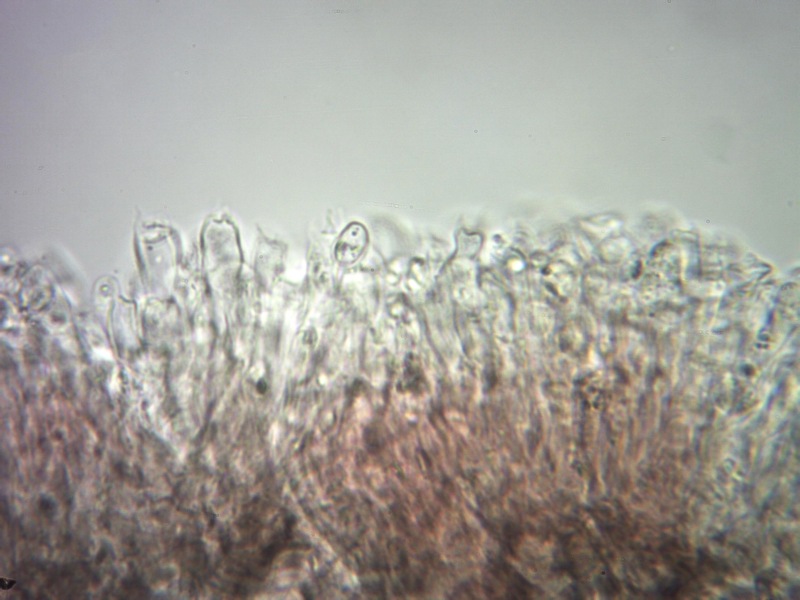
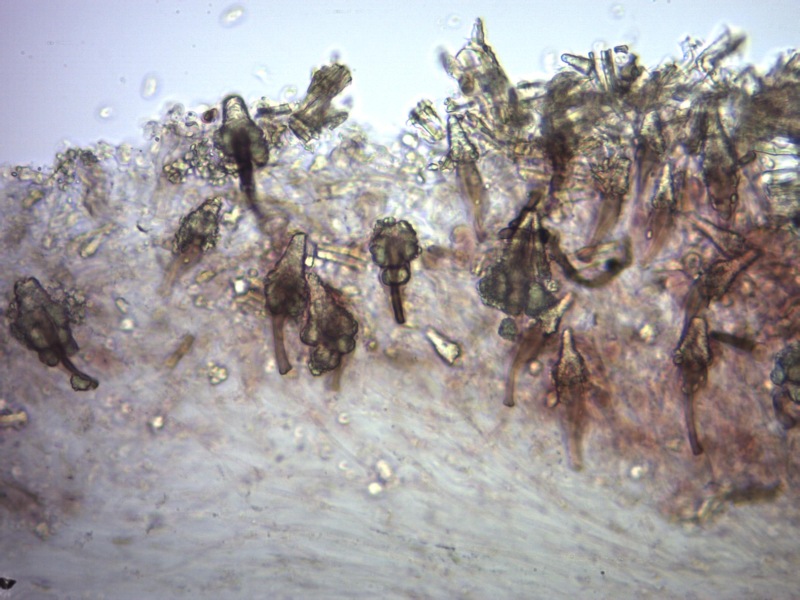
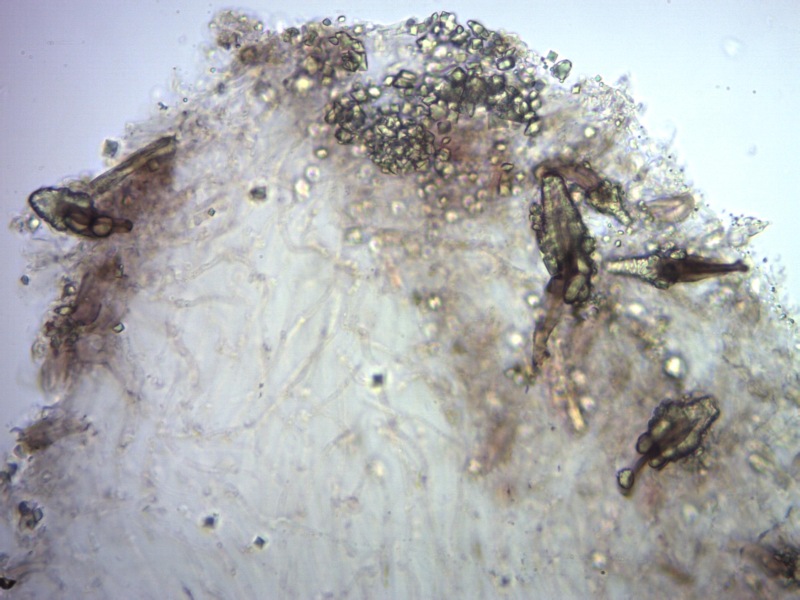

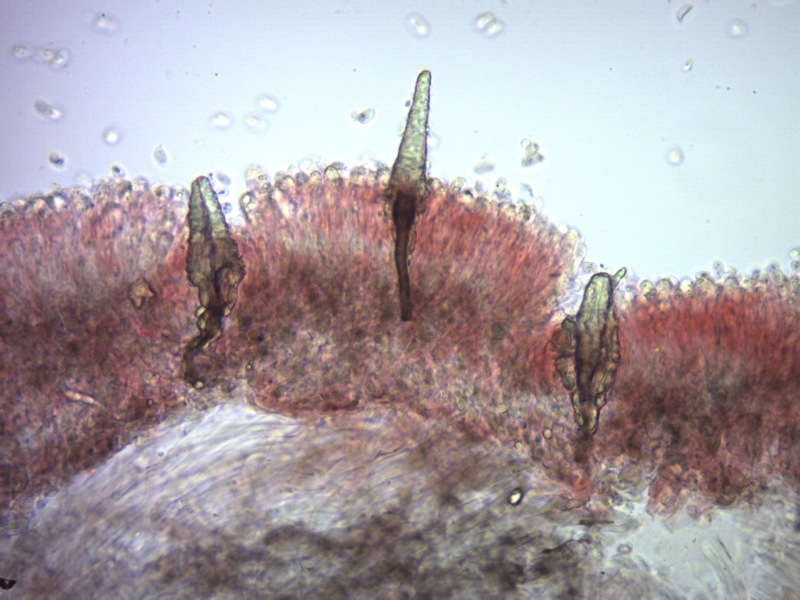
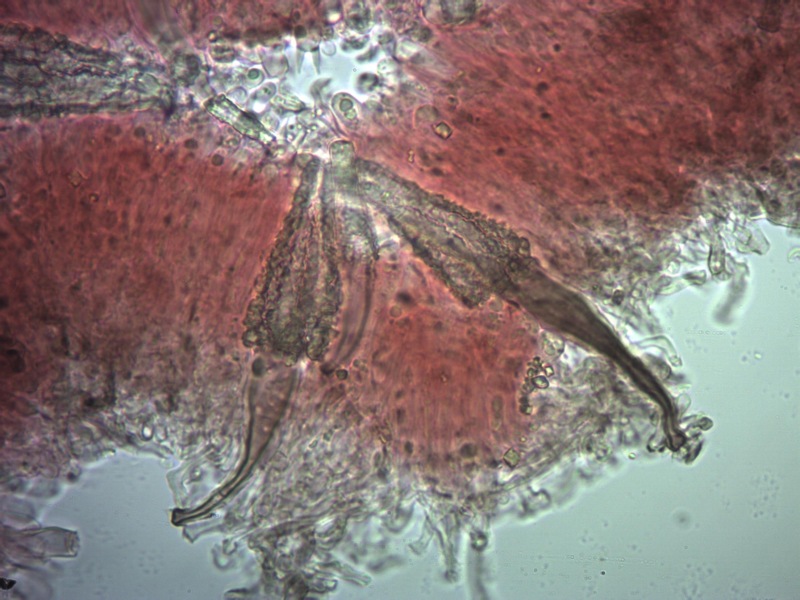
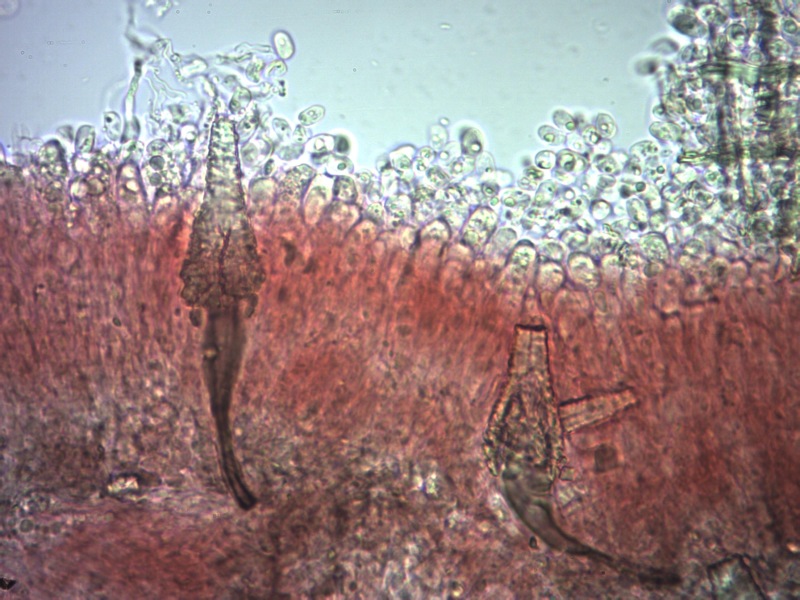
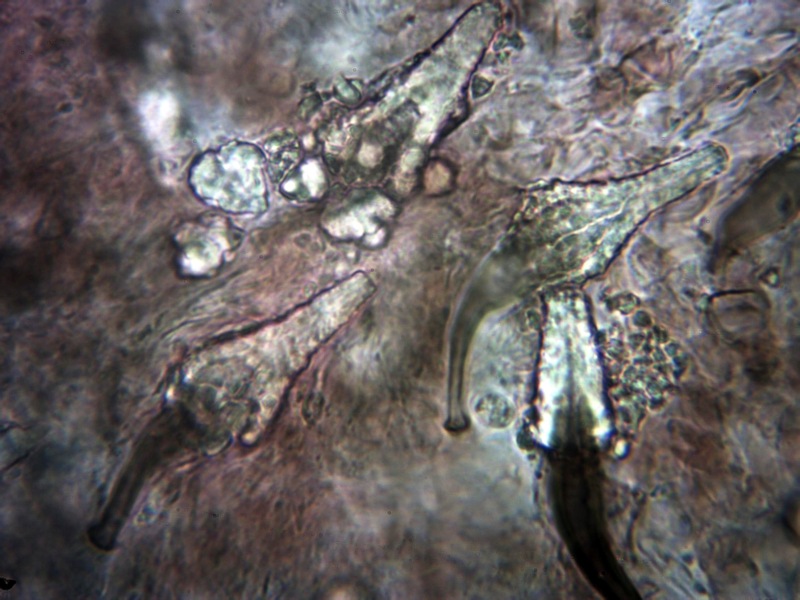























Cordyceps militaris (L. : Fr.) Fr. 1818
in Funghi Non Commestibili o Sospetti
Inviato
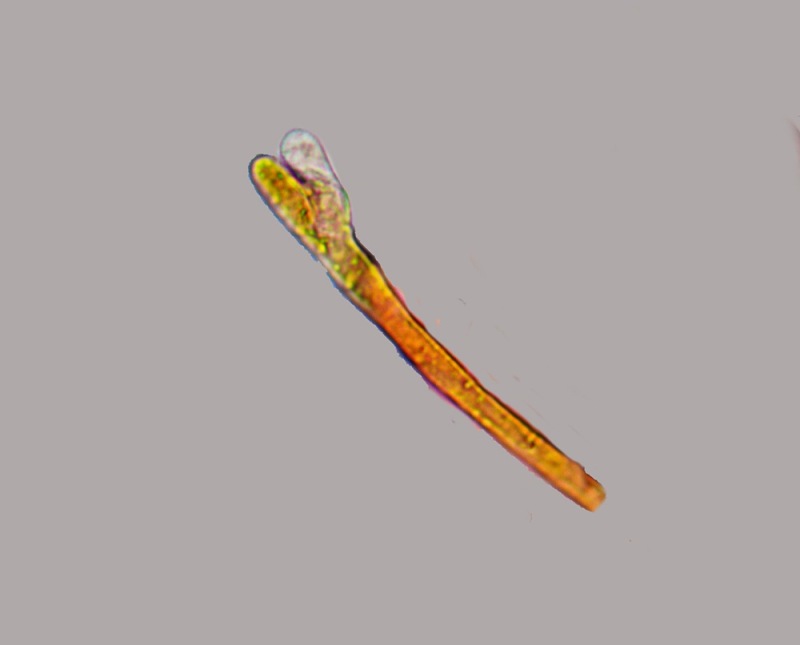
Cordyceps militaris (L. : Fr.) Fr.; Regione Lombardia; Dicembre 2009: Foto, commento e microscopia di Massimo Biraghi.
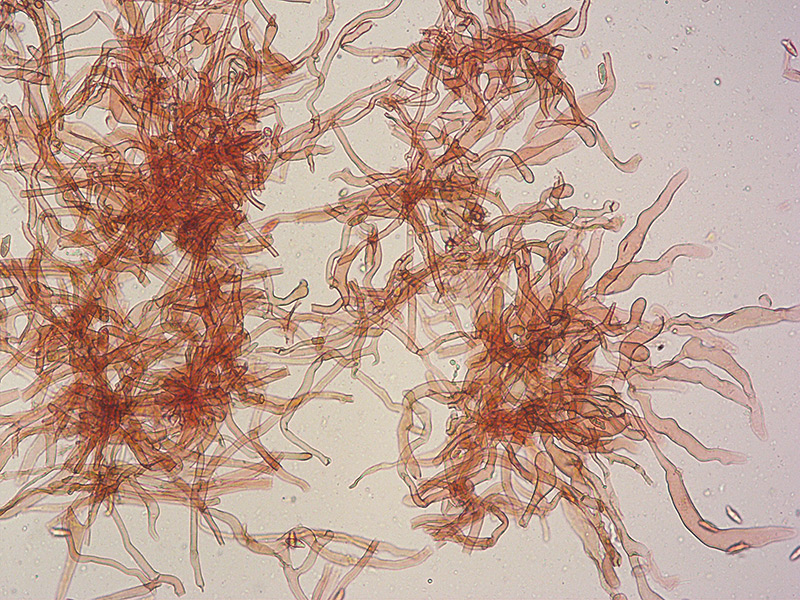
Ascomicete che fruttifica su larve di lepidotteri morte, precedentemente attaccate dal micelio.
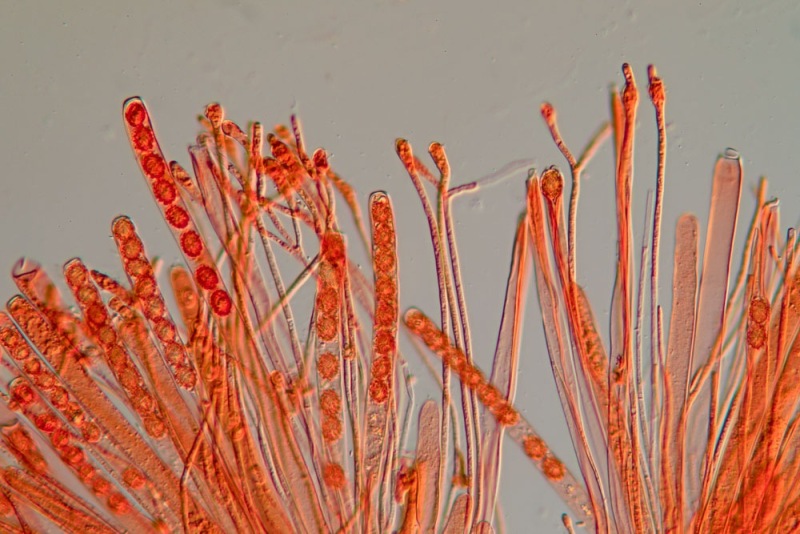
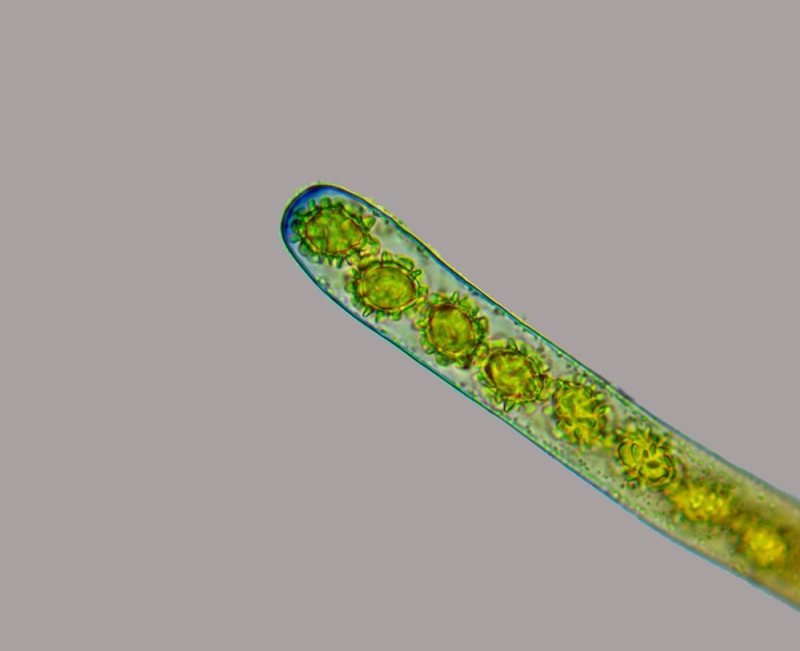
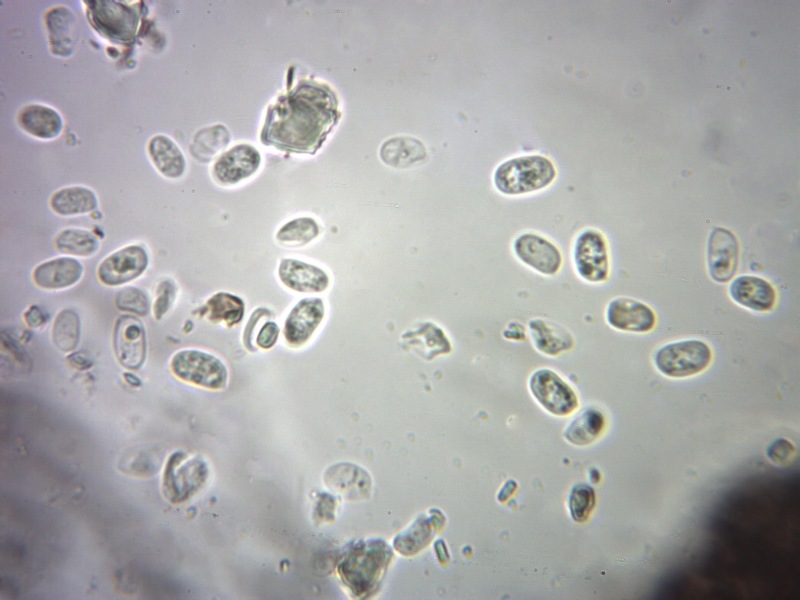
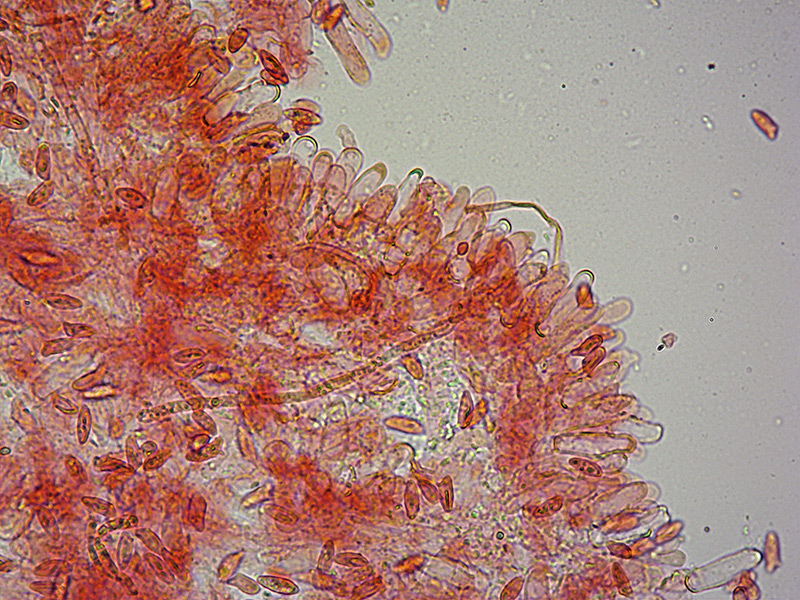
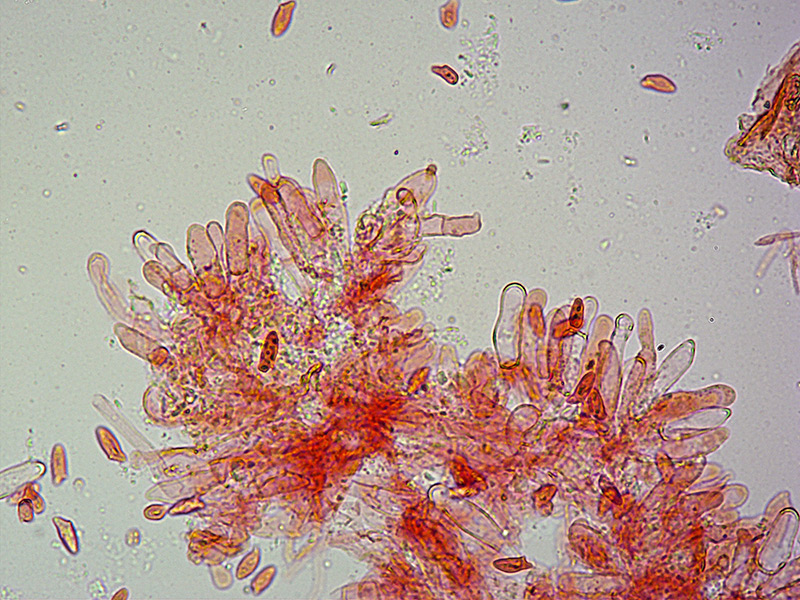
Palizzata degli aschi.
Aschi. Osservazione a 400×.
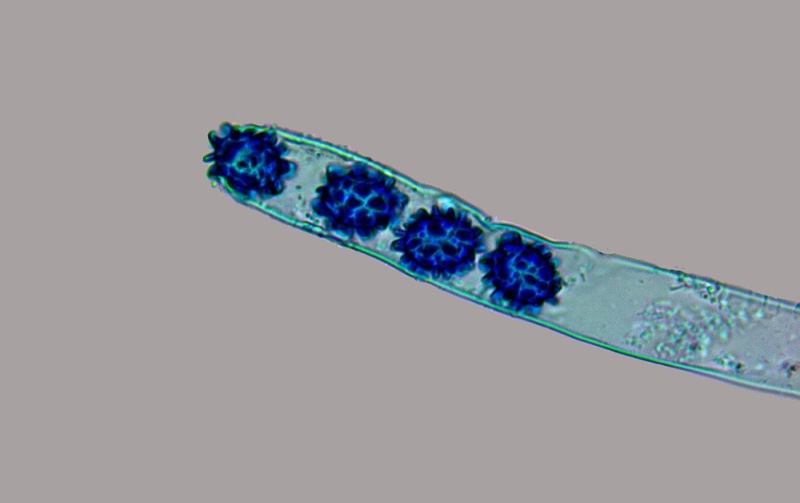
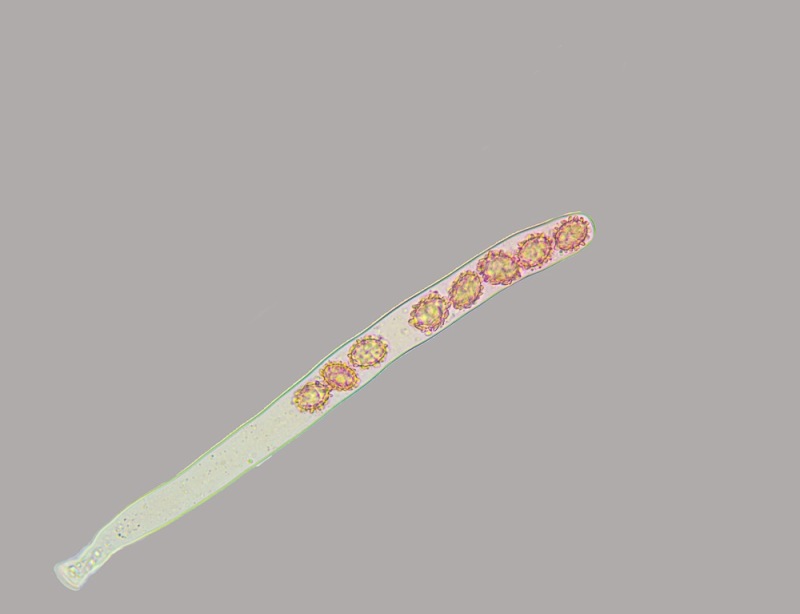
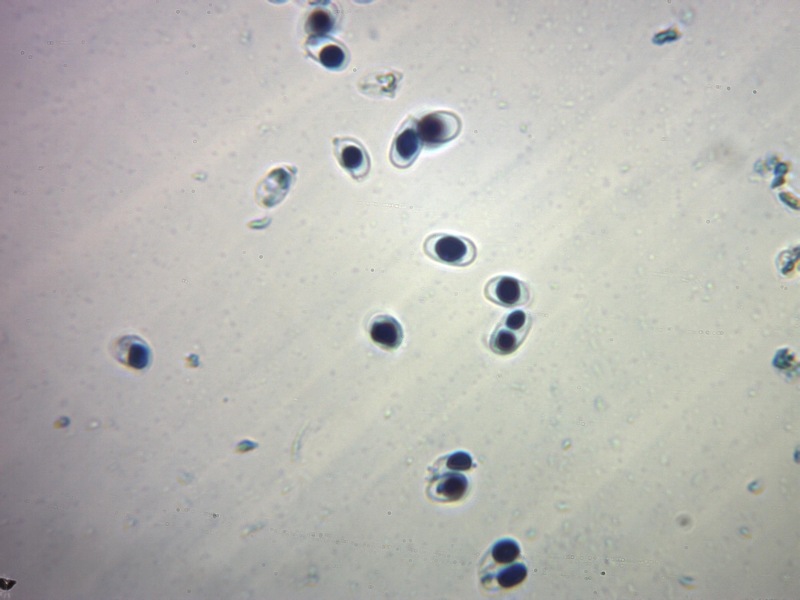
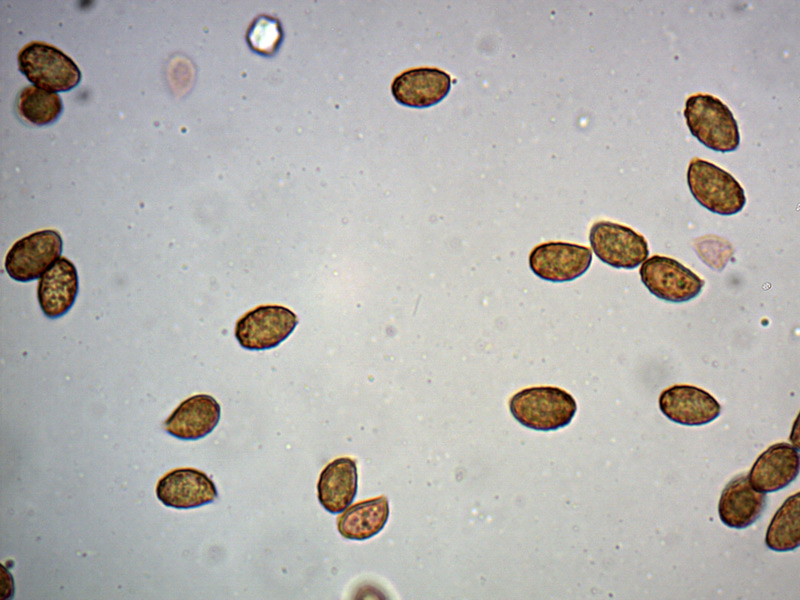
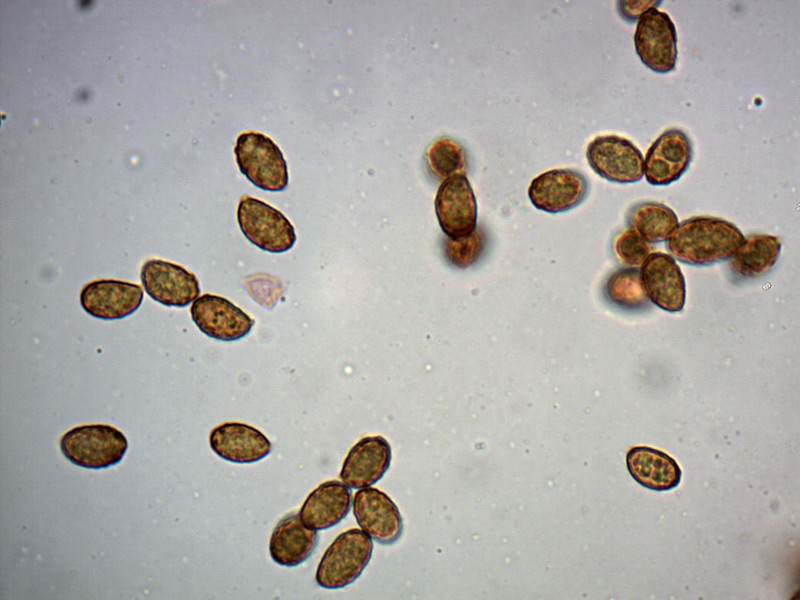
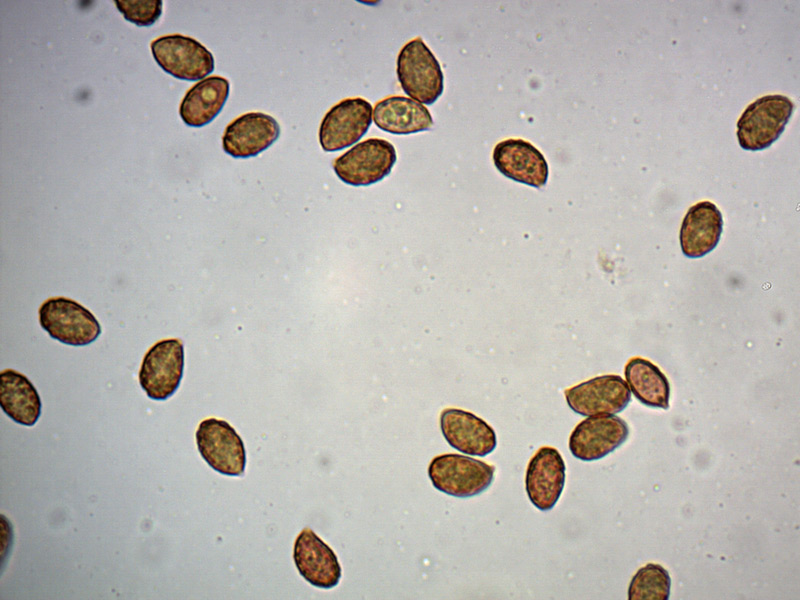
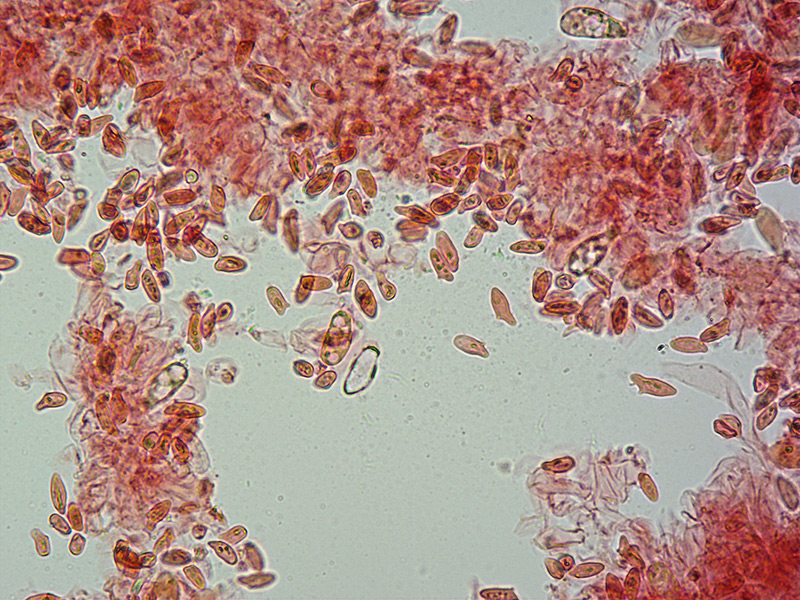
Le ascospore inizialmente sono molto lunghe e filiformi.
Le spore maturando si discaccano in corrispondenza dei setti e generano spore secondarie a forma di piccolo cilindro 4-5(6) × 1,5-2 µm.