-
Numero contenuti
15509 -
Iscritto
-
Ultima visita
Tipo di contenuto
Profili
Forum
Orchidee
Diventa Socio
Calendario
Tutti i contenuti di Archivio Micologico
-

Mycena pura (Pers. : Fr.) P. Kumm. 1871
Archivio Micologico ha postato un topic nell'area Funghi Velenosi
Mycena pura (Pers. : Fr.) P. Kumm. 1871 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Marasmiaceae Sinonimi Prunulus purus (Pers.: Fr.) Murrill 1947 Foto e Descrizioni Specie estremamente variabile nei colori, ma con costanti trasparenze vitree caratteristiche. La variabilità cromatica di questo fungo è notevole, come del resto in molti altri funghi, in questo caso è possibile osservare nelle foto proposte come da dominanti rosee arriviamo a dominanti grigio violacee. Ricordo che nessuna Mycena ha interesse alimentare, anzi molte sono velenose, come la specie presentata, o sospettate di tossicità per le molte annotazioni in letteratura che mettono in guardia dal consumo di questo fungo. L'odore sgradevole come di ravanello molto maturo e la carne insapore ed esigua dovrebbero scongiurare l'uso alimentare. Regione Lombardia; Foto di Federico Calledda. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena polygramma f. candida (Gillet) Buch; Regione Marche; Ottobre 2010; Foto e Microscopia di Mauro Cittadini. Descrizione Basidiomi completamente bianchi, con cappello conico-campanulato striato solcato dal margine sino a circa metà del raggio. Lamelle mediamente fitte e soffuse di rosa, odore lieve un po' di radice, gambo pressochè liscio con base ingrossata e presenza di peluria alla base. Microscopia Spore 8,5-10 (11) × 6-6,5 (7) µm, largamente ellissoidi, bianche in massa, amilodi. Basidi clavati in prevalenza bisporici. Cheilocistidi clavati con corti diverticoli, ma alcuni anche con escrescenze lunghe e ramificate. Pleurocistidi non osservati. Spore. Basidi bispori, in Rosso Gongo e Blu di metile Cheilocistidi Foto di Pietro Curti. Margine del cappello e colore dell'imenoforo. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena polygramma (Bull.: Fr.) S.F.Gray; Regione Umbria; Novembre 2012; Foto di Mario Iannotti; Macro sul gambo per evidenziare le striature che lo percorrono longitudinalmente. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena polygramma (Bull.: Fr.) S.F.Gray; Regione Lombardia; Gennaio 2006; Foto di Rensacca. Parco del Ticino. Gambo con striature longitudinali evidenti alla sommità. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena polygramma (Bull.: Fr.) S.F.Gray; Regione Lombardia, Valle Camonica ; Ottobre 2011; Foto di Lorenzo Martinelli. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena polygramma (Bull.: Fr.) S.F.Gray; Regione Lombardia, parco del Ticino; Settembre 2007; Foto di Rensacca. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena polygramma (Bull.: Fr.) S.F.Gray; Ottobre 2005; Foto di Felice Di Palma. Particolare dell'imenio. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
-

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena polygramma (Bull.: Fr.) S.F.Gray; Regione Lombardia, giardini di Crema; Giugno 2004; Foto di Emilio Pini. -

Mycena polygramma (Bull.: Fr.) S.F.Gray 1821
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
Mycena polygramma (Bull.: Fr.) S.F.Gray 1821 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Marasmiaceae Foto e Descrizioni Riconoscibile macroscopicamente per avere lo stipite percorso longitudinalmente da profonde striature. Le tipiche striature longitudinali si notano meglio nei giovani esemplari. Regione Lombardia; Ottobre 2011; Foto, commento e microscopia di Massimo Biraghi. Particolare delle lamelle Microscopia Spore 8-10(10,5) × 5,5-6,5 µm, largamente ellissoidali. Basidi 30-40 × 8-10 µm, tetrasporici, clavati. Cheilocistidi irregolarmente claviformi o fusiformi con prolungamento/i digitaliforme. Ife della trama lamellare cilinfriche. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.;, Regione Umbria; Novembre 2013; Foto di Stefano Rocchi. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.; Regione Marche; Giugno 2012; Foto di Pietro Curti. Pileo, gambo e imenoforo. Imenoforo. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.; Regione Marche; Ottobre 2010; Foto di Pietro Curti. Macro del filo lamellare. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.; Regione Lazio, Campaegli, Monti Simbruini; Giugno 2009; Foto di Mauro Cittadini. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél., Regione Umbria; Ottobre 2009; Foto di Pietro Curti. Una Mycena dal filo lamellare bruno porpora. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél., Regione Lazio; Novembre 2008; Foto di Tomaso Lezzi. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.;, Regione Umbria; Maggio 2008; Foto di Tomaso Lezzi. Macro del filo lamellare, dal colore viola scuro, quasi nero per i cistidi presenti, riuniti a mazzetti. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.; Regione Sardegna; Raduno Novembre 2007; Foto di Tomaso Lezzi. Macro del filo lamellare. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.; Regione Sardegna; Raduno Novembre 2007; Foto di Massimo Biraghi. Particolare del filo lamellare. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél.; Regione Lombardia, Val Nure, App. piacentino; Settembre 2005; foto di Massimo Biraghi. -

Mycena pelianthina (Fr.: Fr.) Quél. 1872
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
Mycena pelianthina (Fr.: Fr.) Quél. 1872 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Marasmiaceae Foto e Descrizioni Dall'aspetto molto simile alla Mycena pura, anche se più robusta, con il suo filo lamellare bruno porpora ci aiuta subito per una facile determinazione. Regione Sardegna, raduno AMINT; Novembre 2007; Foto e commento di Pietro Curti. -

Mycena niveipes (Murrill) Murrill 1916
Archivio Micologico ha postato un topic nell'area Funghi Non Commestibili o Sospetti
Mycena niveipes (Murrill) Murrill 1916 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Marasmiaceae Foto e Descrizioni Piuttosto simile alla M. galericulata, si differenzia per l'odore talvolta (non sempre) nitroso e per i cistidi lisci e non diverticolati. Foto e commento di Mario Cervini. I cistidi inequivocabilmente lisci. -

Mycena meliigena (Berk. & Cooke) Sacc. 1887
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena meliigena (Berk. & Cooke) Sacc.; Raduno in Sardegna; Novembre 2000; Foto e verifica micro di Mauro Cittadini. -

Mycena meliigena (Berk. & Cooke) Sacc. 1887
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Mycena meliigena (Berk. & Cooke) Sacc.; Raduno in Sardegna; Novembre 2000; Foto e verifica micro di Mauro Cittadini. -

Mycena meliigena (Berk. & Cooke) Sacc. 1887
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
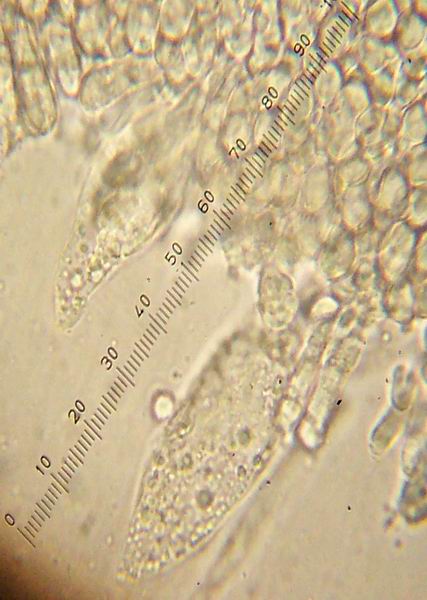
Mycena meliigena (Berk. & Cooke) Sacc.; Regione Lazio; Commento, foto e verifica microscopica di Mauro Cittadini. (Determinazione confermata da G. Robich.) "Alla Sez. Supinae Konrad & Maubl. appartengono delle Mycena di piccola taglia (max. 10 mm), con habitat corticolo (spesso cortecce muschiose). La distinzione con la Sez. Hiemales, ed in particolare con Mycena alba avviene in base al carattere micro della conformazione dei cheilocistidi (lisci inM.alba). In particolare M. supina e M. meliigena sono molto simili, possedendo una vasta sfumatura di colorazioni possibili e crescendo a detta di G. Robich, spesso frammiste. Il nostro ritrovamento lo assegnerei a M.meliogena, a causa della presenza contemporanea di basidi bi-quadrisporici e soprattutto ai cheilocistidi con terminali lunghi ed intrecciati. Le specie citate appaiono comunque molto vicine e difficilmente separabili senza accurata analisi micro." Microscopia "Basidi bi-quadrisporici 29-38 x 8,5-10 micron, con lunghi sterigmi fino a 9 micron, spore sferiche 8-11,5 alcune subglobose con diff. max l-h 1,5 micron, Cheilocistidi con terminali lunghi e ramificati."