-
Numero contenuti
15510 -
Iscritto
-
Ultima visita
Tipo di contenuto
Profili
Forum
Orchidee
Diventa Socio
Calendario
Tutti i contenuti di Archivio Micologico
-

Coprinellus micaceus (Bull. : Fr.) Vilgalys, Hopple & Jacq. Johnson 2001
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
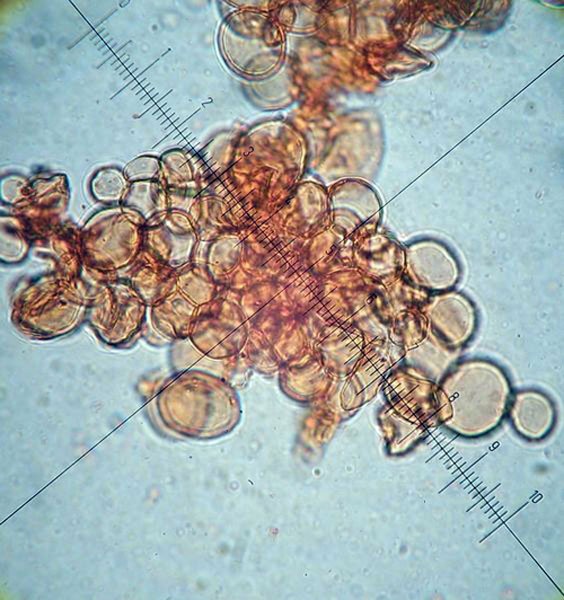
Coprinellus micaceus (Bull. : Fr.); Regione Toscana; Giugno 2020; Foto di Tomaso Lezzi. Campione verificato microscopicamente da Giovanni Galeotti. Stesso campione del post precedente. Velo a cellule globose (sez. Veliformes, subsez. Micacei). Cheilocistidi ellissoidali, subglobosi. Spore ellissoidali in proiezione laterale, distintamente mitriformi in proiezione frontale, presenza di caulocistidi. -

Coprinellus micaceus (Bull. : Fr.) Vilgalys, Hopple & Jacq. Johnson 2001
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
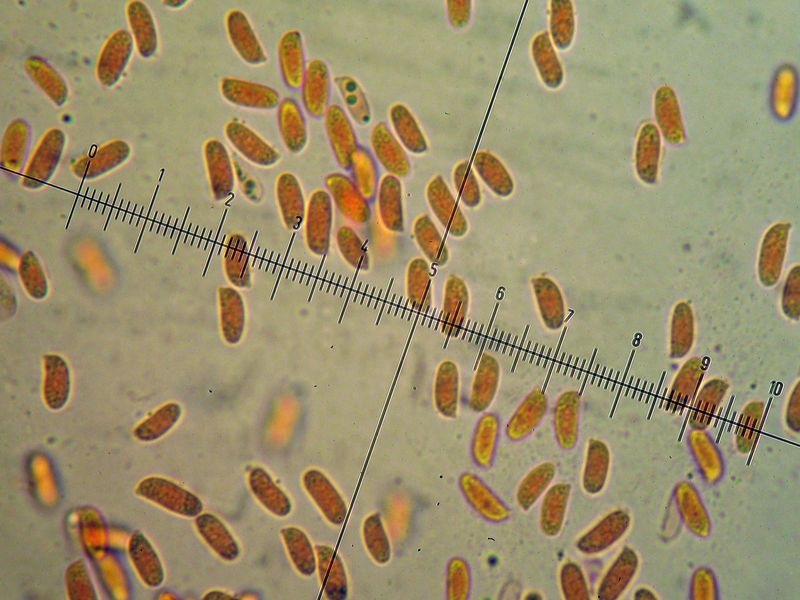
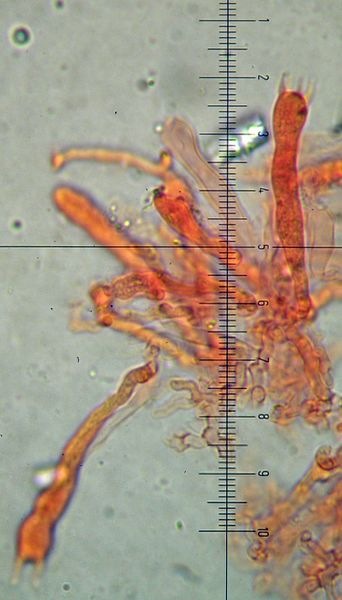
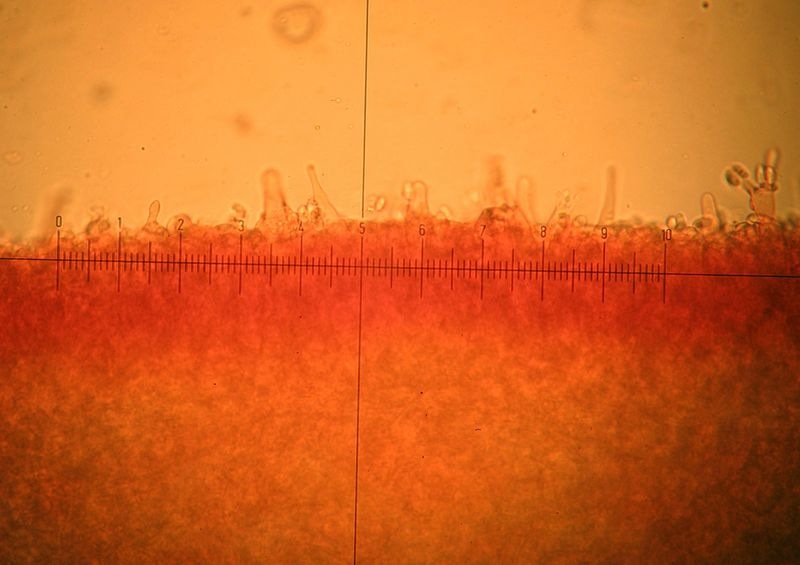
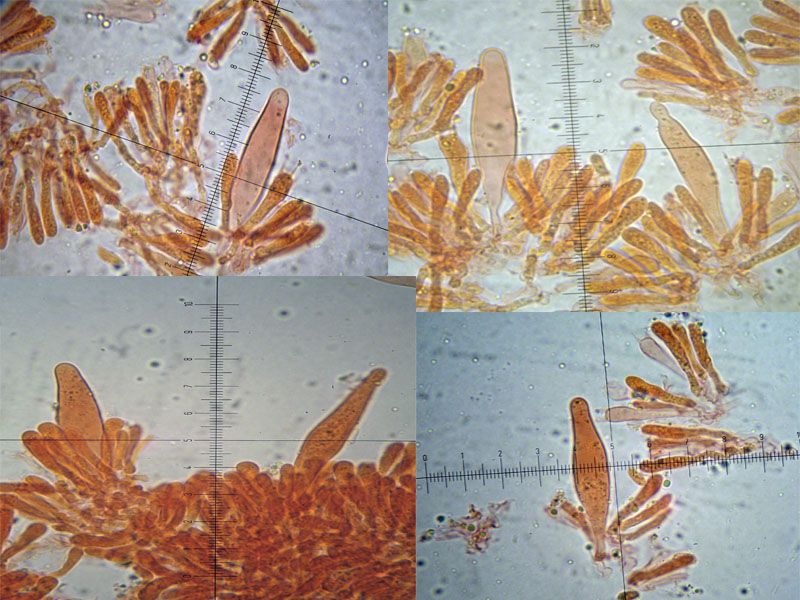
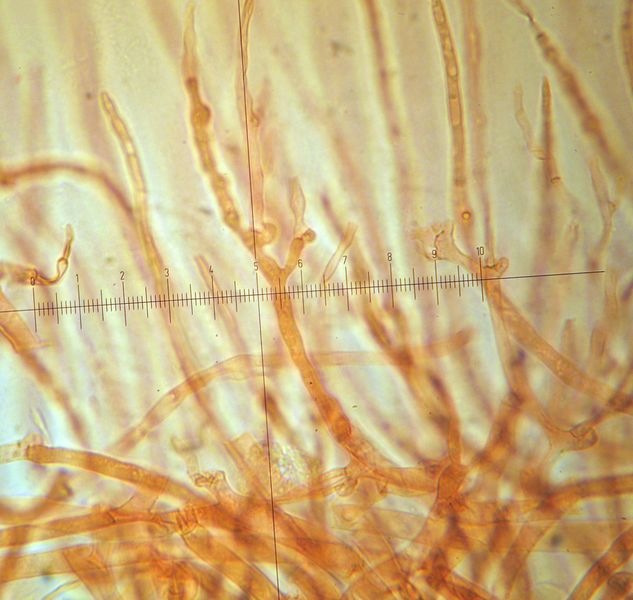
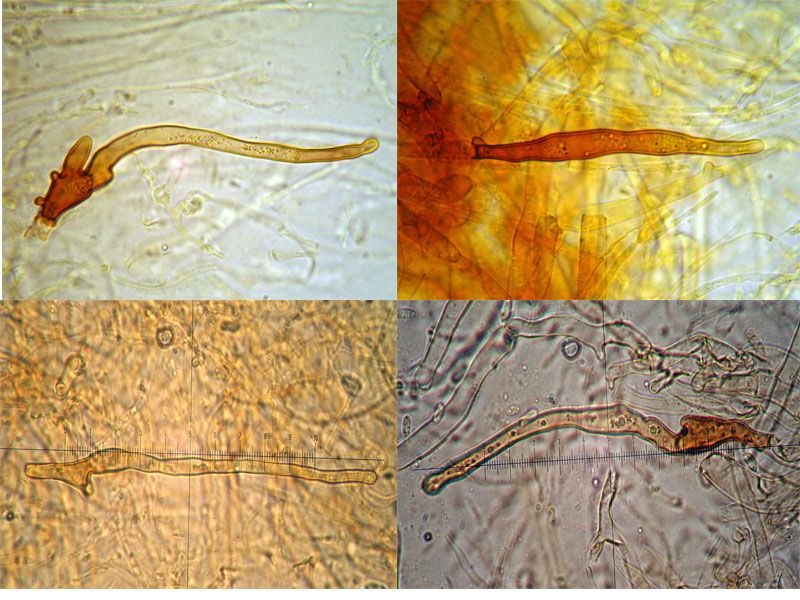
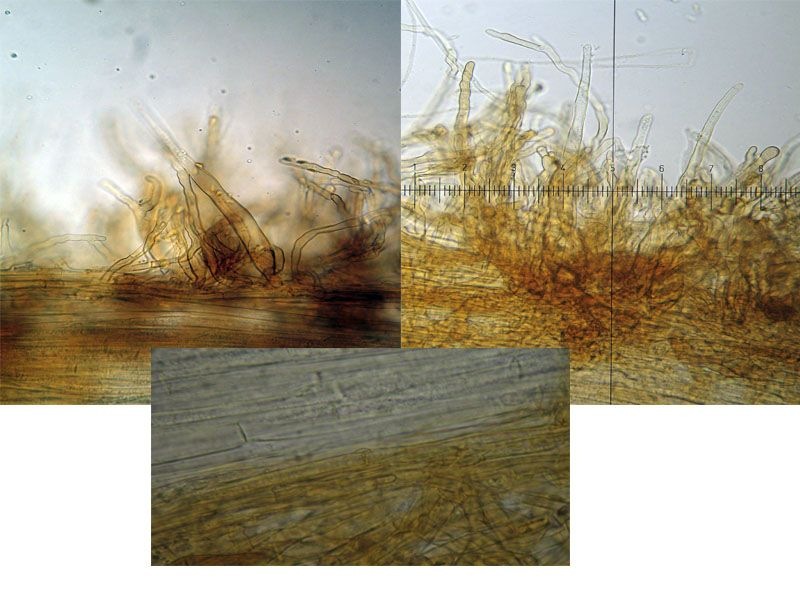
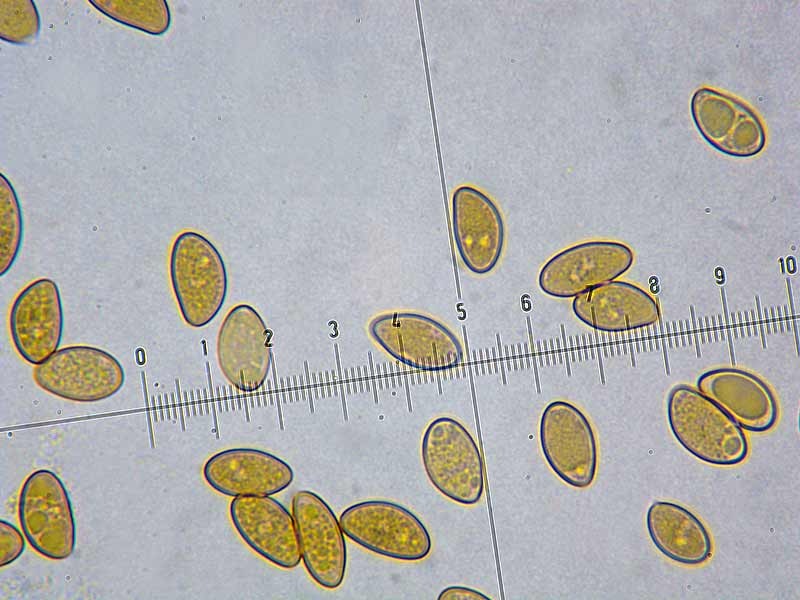
Coprinellus micaceus (Bull. : Fr.); Regione Toscana; Giugno 2020; Foto e microscopia di Giovanni Galeotti. Velo a cellule globose. Cheilocistidi ellissoidali, subglobosi. Spore ellissoidali in proiezione laterale, mitriformi in proiezione frontale (6,2) 6,6-8,3 (8,8) × (3,9) 4,2-5,3 (5,5) µm; Q = (1,3) 1,4-1,8 (1,9); N = 32; Media = 7,4 × 4,7 µm; Qm = 1,6. Velo a cellule globose. Osservazione in rosso Congo, a 100×. Velo a cellule globose. Osservazione in rosso Congo, a 400×. Cheilocistidi ellissoidali, subglobosi. Osservazione in rosso Congo, a 400×. Spore ellissoidali in proiezione laterale, mitriformi in proiezione frontale (6,2) 6,6-8,3 (8,8) × (3,9) 4,2-5,3 (5,5) µm; Q = (1,3) 1,4-1,8 (1,9); N = 32; Media = 7,4 × 4,7 µm; Qm = 1,6. Osservazione in rosso Congo a 1000×. Basidio tetrasporico. Osservazione in rosso Congo, a 1000×. Pileocistidi. Osservazione in rosso Congo, a 400×. Caulocistidi. Osservazione in Rosso Congo, a 100×. Caulocistidi. Osservazione in rosso Congo, a 400×. -

Gymnopus fusipes (Bull. : Fr.) Gray 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Gymnopus fusipes (Bull. : Fr.) Gray; Regione Toscana; Maggio 2020; Foto di Alessandro Francolini. -

Lactifluus piperatus (L. : Fr.) Roussel 1806
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Velenosi
Lactifluus piperatus (L. : Fr.) Persoon; Regione Toscana; Maggio 2020; Foto di Alessandro Francolini. -

Leucopaxillus macrocephalus (Schulzer) Bohus 1966
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Leucopaxillus macrocephalus Huijsman ex Bohus; Regione Toscana; Maggio 2020; Foto di Alessandro Francolini. Esemplare isolato, giovane; con evidente gambo obeso e radicante. Esemplare di discrete dimensioni, nato a stretto contatto con la base del Cerro. -

Tremella mesenterica Retz. : Fr. 1769
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Tremella mesenterica Retz. : Fr.; Regione Toscana; Maggio 2020; Foto di Alessandro Francolini.- 27 risposte
-
- tremella candida
- tremella mesenterica
- (e 3 in più)
-

Polyporus tuberaster (Jacq. ex Pers. : Fr.) Fr. 1821
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Polyporus tuberaster (Jacq. ex Pers.) Fr.; Regione Toscana; Maggio 2020; Foto di Alessandro Francolini.- 16 risposte
-
- polyporus tuberaster
- polyporus lentus
- (e 1 in più)
-

Tarzetta catinus (Holmsk. : Fr.) Korf & J.K. Rogers 1971
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
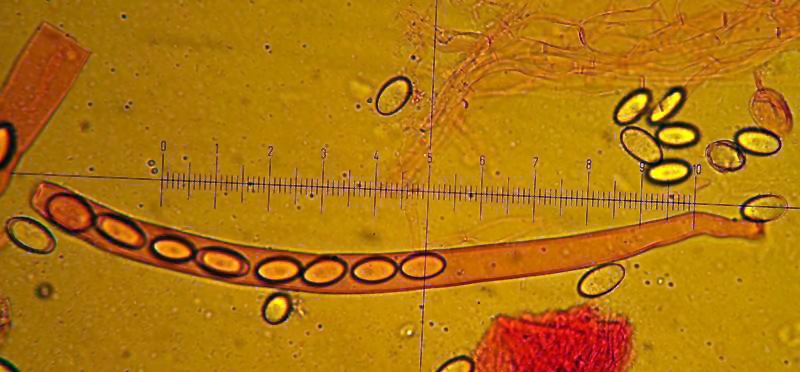
Tarzetta catinus (Holmsk. : Fr.) Korf & J.K. Rogers; Regione Lazio; Marzo 2022; Foto di Antonio Albanese. Aschi e parafisi. Osservazione in rosso Congo. Aschi cilindrici, inamiloidi, ottasporici. Osservazione in rosso Congo. Asco con base allungata. Parafisi cilindriche, filiformi, lobate e diverticolate all'apice. Excipulum medullare a textura intricata. Excipulum ectale a textura globoso-angularis. Spore (19,7) 20,3-22,7 (24,1) × (11,3) 11,4-11,78 (11,8) µm; Q = (1,7) 1,73-2 (2,1); N = 28; Media = 21,4 × 11,5 µm; Qm = 1,9; ialine, ellissoidali, biguttulate. -

Melastiza cornubiensis (Berk. & Broome) J. Moravec 1992
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
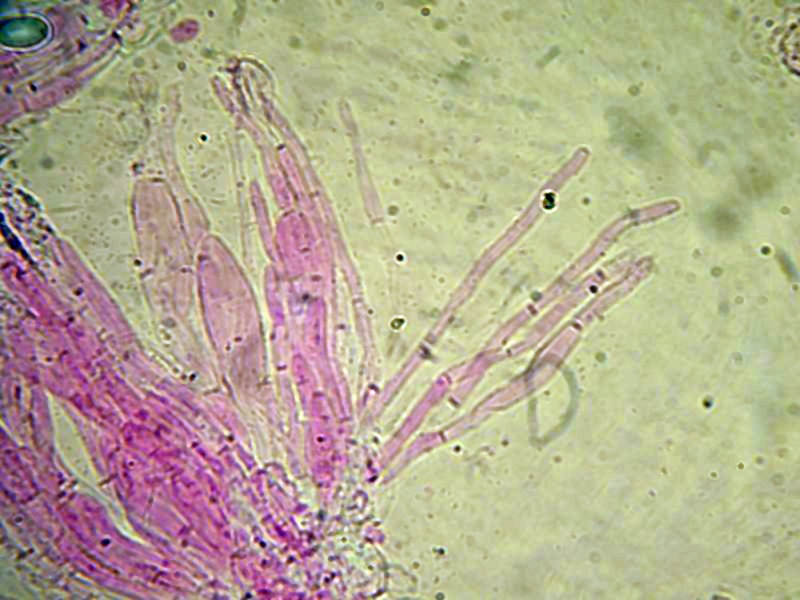
Melastiza cornubiensis (Berk. & Broome) J. Moravec; Regione Umbria; Marzo 2022; Foto e microscopia di Stefano Rocchi. Ascomicete a crescita terricola rinvenuto su giardino privato. Di colore arancio, ha corti peli al bordo dell'apotecio. Spore 16-18 × 8,5-10,3 µm, fusoidi, reticolate e decorate da creste irregolari. Parafisi cilindriche, settate, con apice allargato; peli brunastri, settati, con apice arrotondato. Ringrazio Matteo Carbone che ha confermato la determinazione dei campioni esaminati con esame molecolare. Spore 16-18 × 8,5-10,3 µm, fusoidi, reticolate e decorate da creste irregolari. Osservazione a 1000×. Parafisi cilindriche, settate, con apice allargato. Osservazione in melzer, a 1000×. Peli brunastri, settati, con apice arrotondato. Osservazione in acqua, a 1000×. -

Strobilurus tenacellus (Pers. : Fr.) Singer 1962
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Strobilurus tenacellus (Pers. : Fr.) Singer; Regione Umbria; Marzo 2022; Foto e microscopia di Giovanni Galeotti. Cheilocistidi fusiformi. Osservazione in rosso Congo, a 400×. Pleurocistidi. Osservazione in rosso Congo, a 400×. Pleurocistidi e basidi tetrasporici. Osservazione in rosso Congo, a 1000×. Caulocistidi. Osservazione in rosso Congo, a 400×. Cuticola. Osservazione in rosso Congo, a 400×. Spore(4,7) 4,9-5,9 (6,2) × (2,1) 2,6-3,3 (3,7) µm; Q = (1,6) 1,7-2,2 (2,6); N = 40; Media = 5,5 × 2,9 µm; Qm = 1,9; ellissoidali in vista frontale, faseoliformi in vista laterale. Osservazione in acqua, a 1000×. -

Hebeloma bulbiferum Maire 1937
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Hebeloma bulbiferum Maire; Regione Abruzzo; Ottobre 2017; Foto di Mario Iannotti. Raduno GEMA - Parco Nazionale d'Abruzzo Lazio e Molise - Villetta Barrea (AQ). Facile il riconoscimento di questa specie per il bulbo nettamente delineato alla base del gambo. -

Crepidotus cesatii (Rabenh.) Sacc. 1877
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
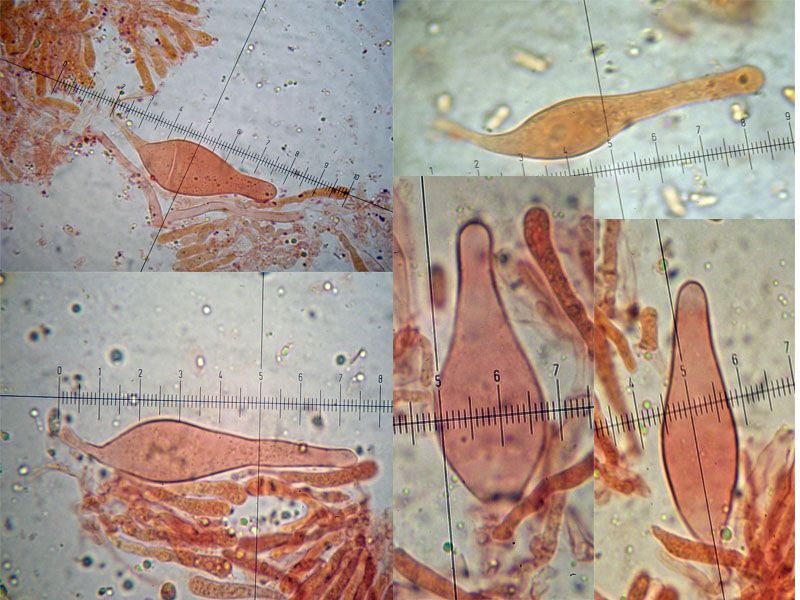
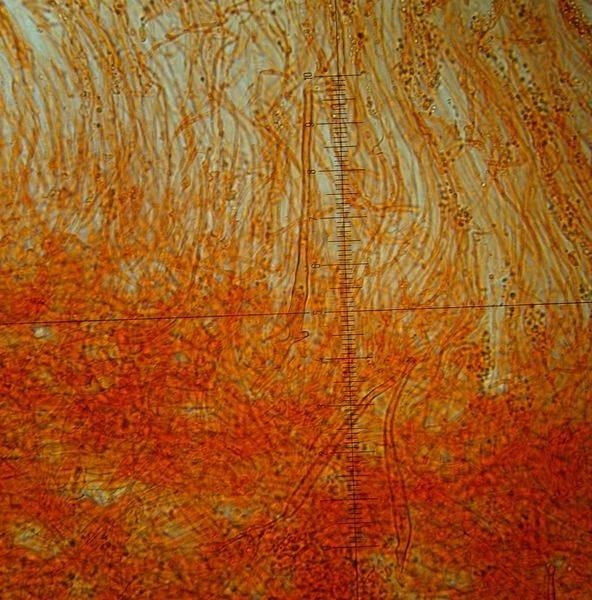
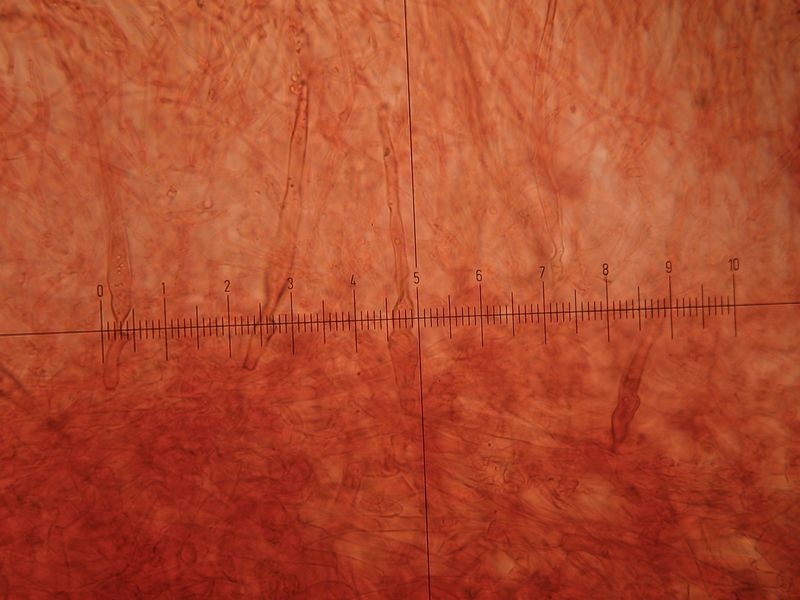
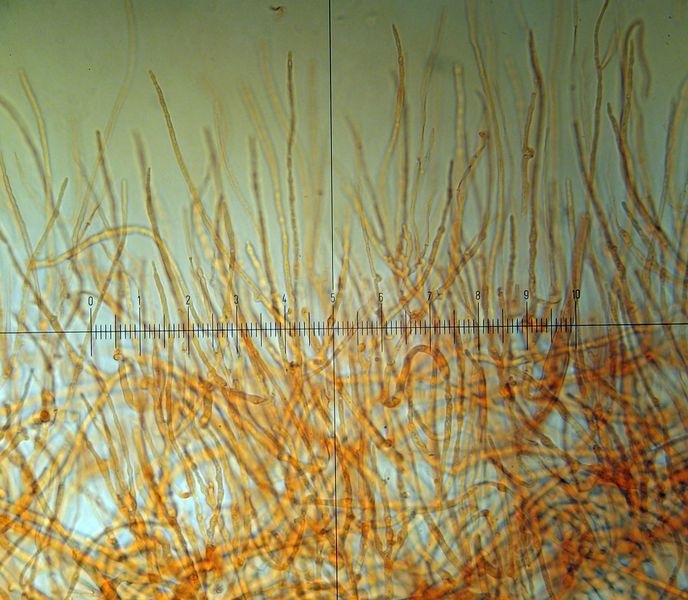
Crepidotus cesatii var. subsphaerosporus (J.E. Lange) Senn-Irletn 1995; Foto e microscopia di Massimo Biraghi. Foto di Federico Calledda. Microscopia Presenza di giunti a fibbia (GAF). Spore subglobose echinulate (7) 8-9 × 6-7. Basidi quadrisporici. -

Agaricus cupressicola Bon & Grilli 1987
Archivio Micologico ha postato un topic nell'area Funghi Commestibili
Agaricus cupressicola Bon & Grilli 1987 Tassonomia Divisione Basidiomycota Classe Agaricomycetes Ordine Agaricales Famiglia Agaricaceae Genere Agaricus Sezione Sanguinolenti (Bivelares vedi paragrafo Note tassonomiche) Subsezione Sylvatici Note tassonomiche Questa specie tradizionalmente era stata ascritta alla sezione Sanguinolenti, ma analisi genetiche degli ultimi anni riconoscono questa specie come appartenente alla sezione Bivelares. Etimologia L'epiteto Agaricus deriva dal greco αγαρικόν = fungo degli Agari; perché secondo Dioscoride proveniva dall'Ucraina, che a quel tempo veniva chiamata "Terra di Agaria". L'epiteto cupressicola deriva dal latino cŭpressus = cipresso e dal suffisso -olo = che ne indica la provenienza; dei cipressi, per l'habitat di crescita. Cappello Bruno, con riflessi lilacini, fibrilloso. A volte presenta placche di velo generale. Lamelle Fitte, libere al gambo, rosa pallido che scuriscono con l’età, fino a diventare bruno-nerastre. Filo lamellare crenulato. Gambo Cilindrico clavato, a volte leggermente bulboso, biancastro, imbrunente verso la base, a volte con presenza di rizoidi sottili. Anello Supero, con la parte superiore bruna. Carne In sezione, soprattutto negli esemplari giovani, vira al rosso scuro violaceo nel cappello e all'arancio nel gambo, soprattutto vicino alla parte esterna del gambo. Odore fungino. Reazioni macrochimiche Reazione di Schäffer negativa. Habitat Specie con tipica crescita sotto Cupressus spp. In letteratura sono riportati rinvenimenti anche sotto Cedrus spp., Populus nigra e Cupressociparis spp. Microscopia Basidi tetrasporici. Cheilocistidi da sferopeduncolati a cortamente clavati. Commestibilità e Tossicità Commestibile. Specie simili Agaricus bresadolanus Bohus 1969 è spesso rinveniblie nello stesso habitat sotto cipresso, ma è molto differente, per il suo leggero odore fenolico e ingiallimento alla base del gambo, i rizoidi corti, ma spessi presenti alla base del gambo, i cheilocistidi molto più allungati. Le specie più vicine appartenenti alla stessa sottosezione Sylvatici sono: Agaricus benesii (Pilát) Pilát, senza resti di velo sul cappello, reazione di Schäffer negativa. Agaricus sylvaticus Schaeff., senza resti di velo sul cappello, reazione di Schäffer positiva, da marrone porpora a viola scuro. Bibliografia PARRA SÁNCHEZ L.A., 2008. Agaricus L., Allopsalliota Nauta & Bas. Fungi Europæi. Vol 1. Alassio (SV): Ed. Candusso. PARRA SÁNCHEZ L.A., 2013. Agaricus L., Allopsalliota Nauta & Bas. Fungi Europæi. Vol 2. Alassio (SV): Ed. Candusso. Scheda di proprietà AMINT realizzata da Tomaso Lezzi - Approvata e Revisionata dal CLR Micologico di AMINT. Regione Umbria; Ottobre 2020; Foto e microscopia di Tomaso Lezzi. Ritrovamento sotto Cupressus macrocarpa. Cheilocistidi sferopenduncolati, cortamente clavati. Osservazione in rosso Congo, a 400×. -

Flammulina velutipes (Curtis : Fr.) Singer 1951
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
Flammulina velutipes (Curtis : Fr.) Singer; Regione Lombardia; Febbraio 2010; Foto di Francesco Mariani. Fungo tipicamente invernale, lignicolo, cresce prevalentemente su ceppaie di latifoglie, lungo le rive fluviali. Spore 6,5-9.5 × 3-3,5(4) µm. Basidi tetrasporici 30-40 × 5,5-6 µm. Filo lamellare. Cistidi imeniali simili 7-18 × 40-80 µm. Particolare. Epicute formata da ife intrecciate, settate, ramificate, con GAF, con presenza di dermatocistidi. Particolare dei dermatocistidi. Particolare, dermatocistidi. Caulocutis con ife flessuose accompagnate da caulocistidi 250 × 16 µm. -

Phylloporus rhodoxanthus (Schw. : Fr.) Bres. 1900
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Phylloporus rhodoxanthus (Schw. : Fr.) Bresadola; Regione Emilia Romagna; Settembre 2020; Foto di Rudi Covino. -

Macrolepiota procera (Scop. : Fr.) Singer 1948
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Commestibili
- 30 risposte
-
- bubbola maggiore
- mazza di tamburo
- (e 2 in più)
-

Mallocybe heimii (Bon) Matheny & Esteve-Rav. 2019
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Velenosi
Mallocybe heimii (Bon) Matheny & Esteve-Rav.; Regione Campania; Gennaio 2022; Foto di Antonio Albanese. Cappello 20-35 mm di diametro, da convesso a piano, margine involuto, cuticola fibrillosa-lanosa, Fulva-brunastra con smuame più scure. Imenoforo a lamelle adnate, spesse, spaziate, di color ocra. Gambo tozzo, leggermente rastremato alla base, cotonoso, concolore al cappello. Carne fibbrosa, ocracea con odore terroso. Spore lisce ellittico-faseoliformi, (7.7) 9.2 - 10.6 (11.1) × (4.3) 4.6 - 5.6 (5.9) µm; Q = (1.6) 1.8 - 2.1 (2.4); N = 30; Me = 9.8 × 5.1 µm; Qe = 1.9. Basidi tetrasporici, cilindrico-clavati. Cheilocistidi di forma variabile, subglobosi, clavati, piriformi a parete sottile. Pleurocistidi non trovati. Caulocistidi non trovati. Note reazione nerastra al KOH sul cappello. Pileipellis. Osservazione in rosso Congo. Cheilocistidi. Osservazione in rosso Congo. Basidi tetrasporici. Osservazione in rosso Congo. Spore. Osservazione in acqua. -

Helvella juniperi M. Filippa & Baiano 1999
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Velenosi
Helvella juniperi M. Filippa & Baiano. Regione Campania. Gennaio 2022. Foto di Antonio Albanese. -

Anthracobia melaloma (Alb. & Schwein. : Fr.) Arnould 1893
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Anthracobia melaloma (Alb. & Schwein. : Fr.) Arnould; Regione Campania; Foto di Antonio Albanese. Aschi e parafisi. Osservazine in rosso Congo. Spore biguttulate con bolla di De Bary. Peli multisettati e concatenati. -

Panaeolus rickenii Hora 1960
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Velenosi
Panaeolus rickenii Hora; Regione Campania; Gennaio 2022; Foto di Antonio Albanese. Lalamelle tipicamente marezzate. Spore. Osservazione in acqua. Cheilocistidi. Osservazione in rosso Congo. Pileipellis. Osservazione in rosso Congo. Caulocistidi. Osservazione in rosso Congo. Caulopellis, ife cilindriche con presenza di giunti a fibbia. Osservazione in rosso Congo. -

Inosperma cervicolor (Pers.) Matheny & Estev-Rav. 2019
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Velenosi
Inosperma cervicolor (Pers.) Matheny & Estev-Rav.; Regione Abruzzo; Ottobre 2010; Foto di Felice Di Palma. Spore (11,0)12,5-15,0 × 7,0-8,5 µm. -

Diderma spumarioides (Fr. & Palmquist) Fr. 1829
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Diderma spumarioides (Fr. & Palmquist) Fr.; Regione Campania; Gennaio 2022; Foto di Antonio Albanese. -

Fomes fomentarius (L. : Fr.) Fr. 1849
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Fomes fomentarius (L. : Fr.) Fr.; ; Regione Lazio; Febbraio 2022; Foto di Tomaso Lezzi. Particolare dei pori sul lato inferiore. -

Peziza vesiculosa Bull. 1790
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
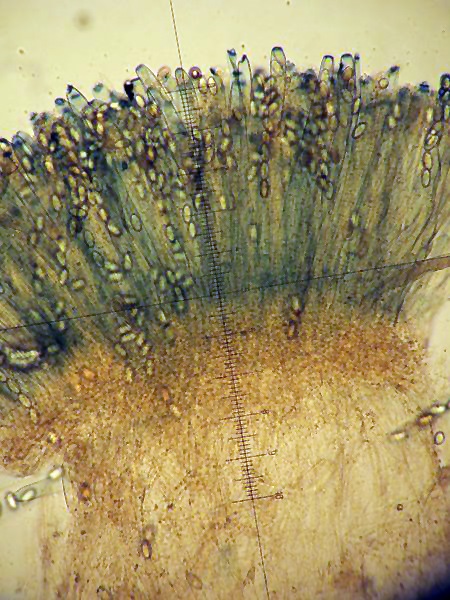
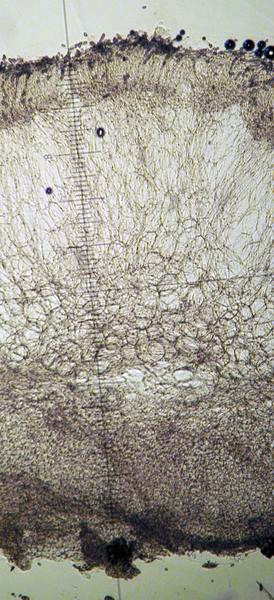
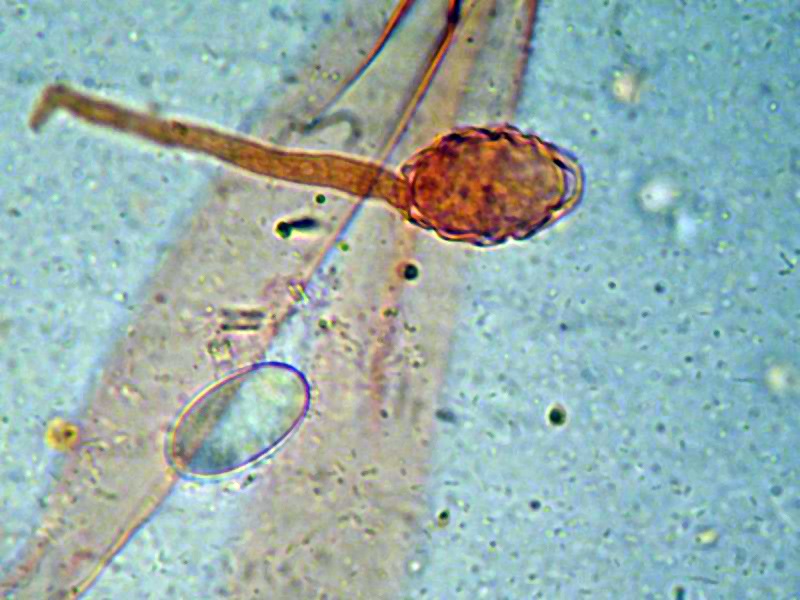
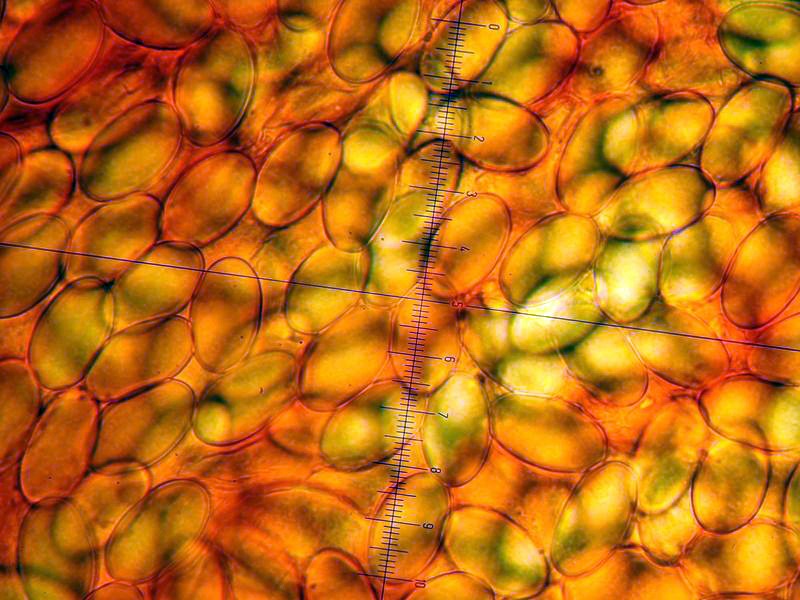
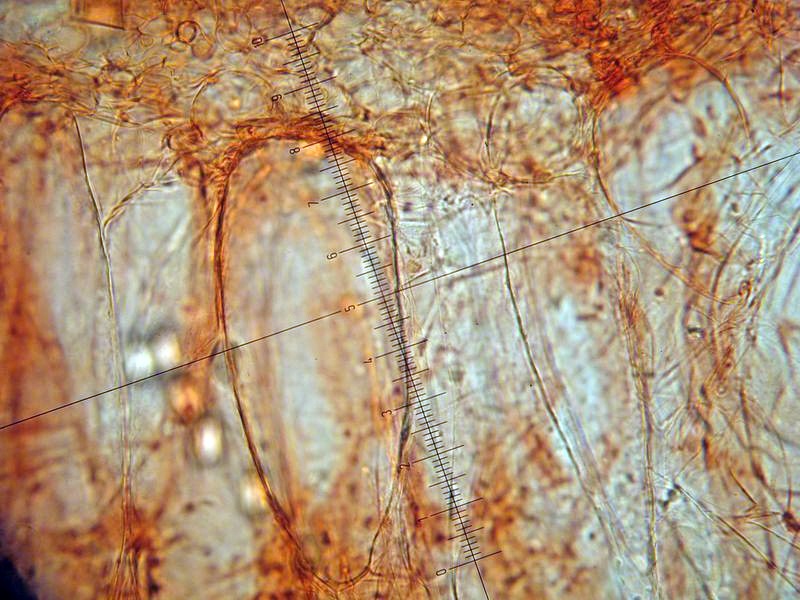
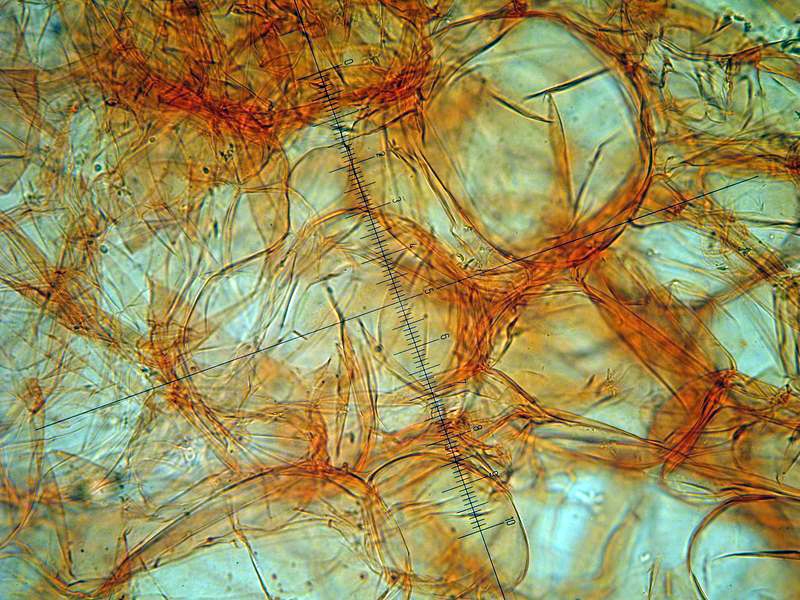
Peziza vesiculosa Bull.; Regione Lazio; Febbraio 2022; Foto di Tomaso Lezzi. Ritrovamento effettuato su paglia con stallatico di cavallo, usata per concimare l'orto. Sezione: in alto aschi e parafisi, nella parte intermedia excipulum medullare, nella parte bassa excipulum ectale. Osservazione in melzer, lavaggio con cloralio, 40×. Aschi amiloidi nella parte alta, tipica reazione del genere Peziza. Osservazione in melzer, lavaggio con cloralio, a 200×. Aschi amiloidi nella parte alta, tipica reazione del genere Peziza. Aschi ottasporici; spore ellissoidali, lisce, uniseriate. Osservazione in melzer, lavaggio con cloralio, a 400×. -

Peziza vesiculosa Bull. 1790
Archivio Micologico ha risposto alla discussione di Archivio Micologico in Funghi Non Commestibili o Sospetti
Peziza vesiculosa Bull.; Regione Lombardia; Novembre 2009; Foto e commenti di Angelo Mariani. Raccolta il 29/11/09 su letame di cavallo. Sezione ascoma e aschi. Osservazione in Melzer. Spora in germinazione. Spore 21-23,5 × 11,5-13 µm. Osservazione in Rosso Congo, a 1000×. Aschi lunghi fino a 370 × 19-23 µm; j+. Osservazione in Rosso Congo, a 400×. Parafisi: cilindracee, leggermente allargate all'apice, irregolari, flessuose, settate. Excipulum medullare con cellule più allungate nella parte superiore. Excipulum medullare formato da cellule globose nella parte medio alta e medio bassa. Excipulum ectale formato da cellule globose, sub-globose molto compatte.